高二化学上学期过关卷二
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。共100分,考试时间75分钟。
可能用到的相对原子质量:H—1 C—12 O—16 S—32 Zn—65
第Ⅰ卷(共70分)
一、单项选择题(本大题共21小题,1~14题每小题3分,15~21题每小题4分,共70分。请将正确答案填入本大题后的表格中)
1、
下列说法正确的是( )
A.化学反应中的能量变化都表现为热量的变化
B.吸热反应在不加热的条件一定不能发生
C.需要加热才能发生的反应一定是吸热反应,放热反应在常温下一定很容易发生
D.反应是吸热还是放热必须看旧键断裂时吸收的能量和新键生成时释放的能量的大小
2、下列反应中属吸热反应的是 ( )
A.镁与盐酸反应放出氢气 B.氢氧化钠与盐酸的反应
C.硫在空气或氧气中燃烧 D.Ba(OH)2•8H2O与NH4Cl反应
3、下列化学电池不易造成环境污染的是( )
A.氢氧燃料电池 B.锌锰电池 C.镍镉电池 D.铅蓄电池
|
![]() 4、镍氢电池的总反应式是 H2 + 2NiO(OH) 2Ni(OH) 2,根据此反应式判断,此电池放电时,负极上发生反应的物质是( )
4、镍氢电池的总反应式是 H2 + 2NiO(OH) 2Ni(OH) 2,根据此反应式判断,此电池放电时,负极上发生反应的物质是( )
A.NiO(OH) B.Ni(OH) 2 C.H2 D.H2和NiO(OH)
![]() 5、可逆反应A+3B 2C+2D,在四种不同的情况下的反应速率分别为:
5、可逆反应A+3B 2C+2D,在四种不同的情况下的反应速率分别为:
① νA=0.15 mol/(L·s), ②υB=0.6 mol/(L·s),
③υC=0.4 mol/(L·s), ④υD=0.45 mol/(L·s)。
该反应进行最快的是( )。
A.① B. ②和③
C. ④
D. ①和④
6、下列各组的电极材料和电解液,不能组成原电池的是( )
A.铜片、石墨棒,硫酸铁溶液
B.铜片、石墨棒,硫酸铜溶液
C.锌片、铜片,稀盐酸
D.铜片、银片,硝酸银溶液
7、A、B、C都是金属,把A浸入C的硝酸盐溶液中,A的表面有C析出,A与B和酸溶液组成原电池时,B为电池的负极。A、B、C三种金属的活动性顺序为( )
A.A>B>C B.A>C>B
C.B>A>C D.B>C>A
8、一种“即食即热型快餐”适合外出旅行时使用。其内层是用铝箔包裹的、并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两种化学物质反应,此时便可对食物进行加热,这两包化学物质最合适的选择是 ( )
A.浓硫酸与水 B.生石灰与水
C.熟石灰与水 D.氯化钠与水
9、下列选项中说明乙醇作为燃料的优点是 ( )
①燃烧时发生氧化反应 ②充分燃烧的产物不污染环境
③乙醇是一种再生能源 ④燃烧时放出大量的热
A.①②③ B.①②④
C.①③④ D.②③④
![]()
![]()
![]() 10、下列说法中可以证明反应N2+3H2 2NH3已达到平衡状态的是( ) .
10、下列说法中可以证明反应N2+3H2 2NH3已达到平衡状态的是( ) .
A. 1 mol N≡N键断裂的同时,有3mol H-H键生成
B. 1 mol N≡N键断裂的同时,有3mol H-H键断裂
C. 1 mol N≡N键断裂的同时,有6mol H-H键断裂
D. 1 mol N≡N键断裂的同时,有6mol H-H键生成
11、设C+CO2 2CO(放热反应)反应速率为υ1,N2+3H2 2NH3(吸热反应)反应速率为υ2。对于上述反应,升高温度时, υ1和υ2的变化情况为( )
A. 同时增大
B. 同时减小
C. υ1增大, υ2减小
D. υ1减小, υ2增大
12、一个化学电池的总反应方程式为:Zn+Cu2+==Zn2++Cu,该化学电池的组成可能为( )
| A | B | C | D | |
| 正极 | Cu | Mg | Zn | Fe |
| 负极 | Zn | Zn | Cu | Zn |
| 电解质溶液 | H2SO4 | CuSO4 | ZnCl2 | CuCl2 |
13、 把金属A放入盐B(NO3)2的溶液中,发生如下反应:A+B2+=A2++B,以下叙述正确的是( )
 A.常温下金属A一定能与水反应,B一定不能与水反应
A.常温下金属A一定能与水反应,B一定不能与水反应
B.A与B用导线连接后放入酒精中,一定形成原电池
C.A与B用导线连接后放入B(NO3)2的溶液中,一定有电流产生
D.由A与B形成的原电池,A一定是正极,B一定是负极
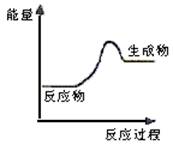
14、 根据右图提供的信息,下列所得结论不正确的是
A.该反应为吸热反应
B.该反应一定有能量转化成了化学能
C.反应物比生成物稳定
D.因为生成物的总能量高于反应物的总能量,所以该反应不需要加热
15、氢气在氯气中燃烧时产生苍白色火焰。在反应过程中,破坏1mol氢气中的化学键消耗的能量为Q1kJ,破坏1mol氯气中的化学键消耗的能量为Q2kJ,形成1mol氯化氢中的化学键释放的能量为Q3kJ。下列关系式中,正确的是 ( )
A.Q1+Q2>Q3 B. Q1+ Q2>2Q3 C. Q1+Q2<Q3 D. Q1+ Q2<2Q3
16、下列说法不正确的是( )
A.任何化学反应都能设计成原电池 B.原电池负极上发生氧化反应
C.化学反应的速率和限度均可通过改变化学反应条件而改变
D.化学反应达到平衡状态时,只要条件不改变,各物质的浓度就不再改变
17、 在密闭容器中进行如下反应:X2(g)+Y2(g)
![]() 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
A.Y为0.2mol/L B.Y2为0.35mol/L
C.X2为0.2mol/L
D.![]() 为0.4mol/L
为0.4mol/L
18、铝与过量的稀盐酸反应,为了加快反应速率,但是又不影响生成的氢气总量,可以采取的措施是( )
A.加入适量的铝粉 B.加入适量的水
C.加入少量的硫酸铜溶液 D.加入浓度较大的盐酸
19、下列说法中正确的是( )
A.用完的电池可以随意地丢弃
B.增加炼铁高炉的高度可以降低尾气中CO的含量
C.无论加入正催化剂还是加入负催化剂都能大大提高化学反应速率
D.把煤粉碎了再燃烧可以提高煤的燃烧效率
20、对于反应A+B=C,下列条件的改变一定使化学反应加快的是( )
A.增加A的物质的量 B.升高体系的温度
C.减少C的物质的量 D.增加体系的压强
21、在一个密闭容器中,盛有N2和H2,它们的起始浓度分别是1.8 mol·L-1和5.4 mol·L-1,在一定的条件下它们反应生成NH3,10min后测得N2的浓度是0.8 mol·L-1,则在这10min内NH3的平均反应速率是( )
A.0.1 mol·L-1·min-1 B.0.3 mol·L-1·min-1
C.0.2 mol·L-1·min-1 D.0.6 mol·L-1·min-1
选择题答案栏:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 答案 | |||||||
| 题号 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| 答案 | |||||||
| 题号 | 15 | 16 | 17 | 18 | 19 | 20 | 21 |
| 答案 |
第Ⅱ卷(共30分)
二、(本题包括5小题,共30分)
22、(6分)以锌、石墨棒为两极,硫酸铜溶液为电解液组成的原电池的正极是 负极是 ;
正极反应式是 ;
负极反应式是 。
23、(6分)把6molA气体和5molB气体混合后放入2L密闭容器中,在一定条件下发生反应:3A(气)+B(气) ![]() 2C(气)+ xD(气)在5s末时生成2molC,测得D的平均反应速率为0.1mol/(L·s)。则X= 。A的平均反应速率为
。5s末时B的物质的量浓度是
。
2C(气)+ xD(气)在5s末时生成2molC,测得D的平均反应速率为0.1mol/(L·s)。则X= 。A的平均反应速率为
。5s末时B的物质的量浓度是
。
24、 (6分)市场出售的“热敷袋”,其主要成分是铁屑、炭粉、木屑与少量氯化钠、水等。它在使用之前需用塑料袋与空气隔绝。使用时开启塑料袋的小气孔,轻轻揉搓就会放出热量来。当使用完后还会发现有铁锈生成,依上述现象完成下列问题:
(1)“热敷袋”放出热量时铁发生了 反应(填“氧化”或“还原”)。
(2)炭粉的主要作用是 。
(3)加入氯化钠的作用是 。
25、(4分)某温度时,在5 L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如右图所示。请通过计算回答下列问题。
(1)反应开始至2 mim,Y的平均反应速率
。
(2)分析有关数据,写出X、Y、Z的反应方程式
。
![]()
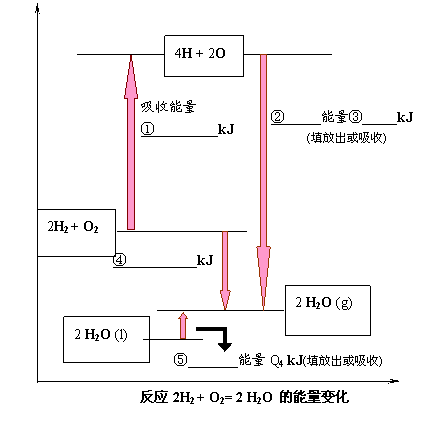 26、(8分)化学反应可视为旧键断裂和新键形成的过程。现提供H2燃烧反应中有关物质的化学键键能: H—H :Q1kJ/ mol、H—O :Q3kJ/ mol、O2分子内氧原子间的键能为Q2kJ/mol。
26、(8分)化学反应可视为旧键断裂和新键形成的过程。现提供H2燃烧反应中有关物质的化学键键能: H—H :Q1kJ/ mol、H—O :Q3kJ/ mol、O2分子内氧原子间的键能为Q2kJ/mol。
请根据上述数据,在下图中标注的数字处,填出能量变化的数值或根据箭头的指向填写能量变化是“放出”热量还是“吸收”热量。
参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | D | D | A | C | C | B | C | B | D | A |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 |
| A | A | C | D | D | A | B | C | D | B | C |
22、石墨棒、锌、Cu2++2e-=Cu、Zn-2e-=Zn2+
23、1、0.3mol/(L·s)、2mol/L
24、(1)氧化 (2)做原电池正极 (3)做电解质溶液
25、(1)0.03mol/(L·min) (2)X(g)+3Y(g)![]() 2Z(g)
2Z(g)
26、①2Q1+Q2 ②放出 ③4Q3 ④4Q3—(2Q1+Q2) ⑤吸收