高二年级化学第一学期期中考试试卷
第Ⅰ卷(共60分)
本卷可能用到的相对原子质量:H 1、C 12、N 14、O 16、F 19、S 32、Cl 35.5、Br 80
一、选择题(每小题仅有一个正确答案,本题共8小题,每小题3分,共24分)
1.生命起源的研究是世界性科技领域的一大课题,科学家模拟和十亿年前地球的还原性大气环境进行紫外线辐射实验(当时无臭氧层),认为生命起源的第一层次是产生了与硝基化合物可能是同分异构体的
A.醇类 B.羧酸类 C.糖类 D.氨基酸
2.下列关于淀粉和纤维素的叙述中,不正确的是
A.它们都是混合物 B.它们都是天然高分子化合物
C.它们是同分异构体 D.它们水解的最终产物都是葡萄糖
3. 下列关于氢原子电子云图的说法正确的是
A. 通常用小黑点来表示电子的多少,黑点密度大,电子数目大。
B. 黑点密度大,单位体积内电子出现的机会大。
C. 通常用小黑点来表示电子绕核作高速圆周运动。
D. 电子云图是对运动无规律性的描述。
4. 下列各原子或离子的电子排列式错误的是
A. Na+ 1s22s22p6 B. F¯ 1s22s22p6
C. N3+ 1s22s22p6 D. O2¯ 1s22s22p6
5.NaF、NaI、MgO均为离子化合物,根据下列数据,判定这三种化合物的熔点高低顺序是化学式: ① NaF ② NaI ③ MgO
离子电荷数: 1 1 2
键长(10—10m): 2.31 3.18 2.10
A.①>②>③ B.③>①>② C.②>①>③ D.③>②>①
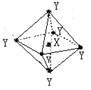 6.在某晶体中,与某一种微粒X距离最近且等距离的另一种微粒Y 所围成的空间构型为正八面体(如图)。该晶体可能是
6.在某晶体中,与某一种微粒X距离最近且等距离的另一种微粒Y 所围成的空间构型为正八面体(如图)。该晶体可能是
A.NaCl B.CsCl
C.CO2 D.SiO2
7.元素性质呈周期性变化的决定因素是
A.元素原子半径大小呈周期性变化 B.元素原子量依次递增
C.元素原子最外层电子排布呈周期性变化 D.元素的最高正化合价呈周期性变化
8.下列轨道表示式能表示氮原子的最低能量状态的是
A. 1S 2S 2P B. 1S 2S 2P
C. 1S 2S 2P D. 1S 2S 2P
二、选择题(每小题有1~2个正确答案,本题共12小题,每小题3分,共36分)
9. x、y为两种元素的原子,x的阴离子与y的阳离子具有相同的电子层结构,由此可知
A.x的原子半径大于y的原子半径。 B.x的电负性大于y的电负性。
C.x 的氧化性大于y的氧化性。 D.x的第一电离能大于y 的第一电离能。
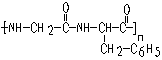 |
10.某高分子链为 可用于合成该链的单体为
A.甘氨酸 B.丙氨酸 C.苯丙氨酸 D.谷氨酸
11.葡萄糖的分子式为C6H12O6,通过缩合反应把10个葡萄糖分子连结起来所形成的链状化合物的化学式为
A.C60H120O60 B.C60H100O52 C.C60H102O51 D.C60H112O51
12.1997年,英国的“克隆羊”备受世界关注。“克隆羊”的关键技术之一是找到一些特殊的酶,这些酶能激活普通体细胞使之像生殖细胞一样发育成个体。有关酶的叙述错误的是
A.酶是具有催化作用的蛋白质 B.酶的催化作用具有选择性和专一性
C.高温或重金属盐能降低酶的活性 D.酶只有在强酸或强碱性条件下才能起作用
13.下列配合物的配位数不是6的是
A、K2[Co(NCS)4] B、Na2[SiF6] C、Na3[AlF6] D、[Cu(NH3)4]Cl2
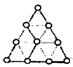 14.右图是正四面体的原子簇Aun一个三角面图,根据右图确定
14.右图是正四面体的原子簇Aun一个三角面图,根据右图确定
Aun中的n数值为
A.10 B.16 C.18 D.20
15.组成晶体的质点(分子、原子、离子)以确定的位置在空间作有规则排列,具有一定几何形状的空间格子,称为晶格,晶格中能代表晶体结构特征的最小重复单位称为晶胞。在冰晶石(Na3AlF6)晶胞中,AlF63-占据的位置相当于NaCl晶胞中C1-占据的位置,则冰晶石晶胞中含有的原子数与食盐晶胞中含有的原子数之比为
A.2:1 B.3:2 C.5:2 D.5:1
16.根据下列五种元素的电离能数据(单位:kJ/mol),回答下面各题。
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
(1)在周期表中,最可能处于同一族的是
A Q和R B S和T C T和U D R和T E R和U
(2)电解它们的熔融氯化物,阴极电极反应式最可能正确的是
A Q2++2e-→Q B R2++2e-→R C S3++3e-→S
D T3++3e-→T E U2++2e-→U
(3)它们的氯化物的化学式,最可能正确的是
A QCl2 B RCl C SCl3 D TCl E UCl4
(4)S元素最可能是
A S区元素 B 稀有气体元素 C p区元素 D 准金属 E d区元素
(5)下列元素中,化学性质和物理性质最像Q元素的是
A 硼(1s22s22p1) B 铍(1s22s2) C 锂(1s22s1) D 氢(1s1) E 氦(1s2)
第Ⅱ卷(共60分)
三、填空题(本题共4小题,共48分)
17.(18分) A、B、C三种短周期元素,原子序数依次增大,三种元素序数之和为35,A、C同族,B+离子核外有10个电子,回答下列问题
①A、B、C三种元素分别是_________ 、 _________ 、_________。
②A、B、C之间任取两种能形成多种化合物,其中属于离子化合物的化学式分别为_________ 、 __________ 、___________
③分别写出A、B、C的电子排列式:
A._____________________、B._____________________、C._____________________
18.(4分) A、B是短周期元素,原子最外层电子排布式分别为mSx、nSxnpx+1。A与B形成的离子化合物加水溶解后可使酚酞溶液变红,同时有气体C逸出,该气体可使湿润的红色石蕊试纸变蓝。则该离子化合物的化学式为 ,气体C的电子式为 。
19.(14分)1932年美国化学家鲍林首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
请仔细分析,回答下列有关问题:
(1) 预测周期表中电负性最大的元素应为____________;估计钙元素的电负性的取值范围:
_________<X<_________。
(2) 根据表中的所给数据分析,同主族内的不同元素X的值变化的规律是 ;简述元素电负性X的大小与元素金属性、非金属性之间的关系________________________。
(3) 经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型为______________,其理由是 。
20.(12分)下表列出了前20号元素中的某些元素性质的有关数据:
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | - |
| 最低价态 | - | - | -2 | - | -4 | -3 | -1 | - | -3 | -1 |
试回答下列问题:
(1) 以上10种元素的原子中,失去核外第一个电子所需能量最少的是 (填写编号)。
(2) 上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式)_______________________________________。某元素R的原子半径为1.02×10-10m,该元素在周期表中位于__________________ ;若物质Na2R是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式_________________。
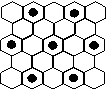 (3) 元素⑤的某种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔融的②单质相互作用,形成某种青铜色的物质(其中的元素②用“●”表示),原子分布如图所示,该物质的化学式为 ___
。
(3) 元素⑤的某种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔融的②单质相互作用,形成某种青铜色的物质(其中的元素②用“●”表示),原子分布如图所示,该物质的化学式为 ___
。
(4)下面二维平面晶体所表示的化学式为AX3的是 ( )
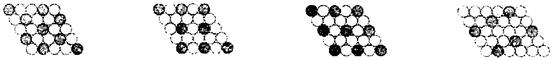
A B C D
四、计算题(本题共2小题,共12分)
21.(6分)将100g含(C6H10O5)n90%的淀粉(杂质不参与反应)水解为葡萄糖(水解率为90%),再将葡萄糖发酵制成乙醇,再将乙醇中的一部分氧化为乙酸。生成的乙酸恰好与未
被氧化的乙醇完全反应生成乙酸乙酯。求可制得乙酸乙酯多少克?
22.(6分)某固体仅由一种元素组成,其密度为5.0g∕cm¯ 3。用X射线研究该固体的结构时得知:在边长为10¯ 7cm的正方体中含有20个原子,则此元素的相对原子质量是多少?
高二年级第一学期期中考试
化学试卷答卷纸
一、二项选择题(每题3分,共60分,若有两个答案,漏选得1分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||||
| 答案 | ||||||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16(1) | 16(2) | 16(3) | 16(4) | 16(5) |
| 答案 |
三、填空题(本题共4小题,共48分)
17.① 、 、 。(填元素符号)
② 、 、
③A. 、B.
C.
18. , 。
19.(1) ____________(填元素符号); <X< 。
(2) ; 。
(3) , 。
20.(1) (填写编号)。
(2) (写分子式)。 ;
。
(3) 。 (4)
四、计算题(共12分)
21.解:
答: 。
22.解:
答: 。
参考答案及评分标准
一、二项选择题(每题3分,共60分,若有两个答案,漏选得1分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||||
| 答案 | D | C | B | C | B | A | C | A | ||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16(1) | 16(2) | 16(3) | 16(4) | 16(5) |
| 答案 | BC | AC | C | D | AD | A | D | E | D | B | A | E |
三、填空题(本题共4小题,共48分)
17.(18分)
① O Na S (每空2分,共6分)
② Na2O2 Na2O Na2S (每空2分,共6分)
③ 0: 1s22s22p4 (2分) Na: 1s22s22p63s1 (2分) S: 1s22s22p61s23s23p4(2分)
18.Mg3N2 (2分) NH3电子式略(2分)
19.(1) F(2分) 0.8(2分) 1.2(2分)
(2)从上向下,x值减小(2分)
电负性越大,非金属性越强,金属性越弱,反之亦然(2分)
(3)共价键(2分) 因为AlCl3中Cl与Al的电负性差值为1.5,而Br的电负性小于Cl,所以AlBr3中两元素的电负性差值小于1.5(2分)
20.(1) ②(2分)
(2)PCl3、CCl4(2分) 第三周期ⅥA族(2分) ![]() (2分)
(2分)
(3)KC8(2分)
(4)BC(2分)
四、计算题(共12分)
21.44g(6分)
22.(6分)该元素的相对原子量为:150.5