高中二年级化学上学期期末考试试卷
说明:本试卷分为第Ⅰ卷和第Ⅱ卷,考试时间90分钟,满分100分。请将第Ⅰ卷试题的正确答案用ⅡB铅笔填涂在答题卡上,将第Ⅱ卷试题的正确答案写在试卷上。
可能用到的相对原子质量:Zn-65 Mg-24 Al-27 Fe-56
第Ⅰ卷 (选择题 共48分)
(本卷包括16小题,每小题3分,共48分,每小题只有一个选项符合题意。)
1.下列反应起了氮的固定作用的是
A.N2与H2在一定条件下反应生成NH3 B.NO与O2反应生成NO2
C.NH3经催化氧化生成NO D.由NH3制碳铵和硫铵
2.下列液体中所含粒子种类最多的是
A.液氨 B.液氯 C.氨水 D.稀硝酸
3.在一只25 mL的碱式滴定管中注入0.1 mol/L的氢氧化钠溶液,其液面恰好在5mL的刻度处,若把滴定管中的溶液全部放入烧杯中,则所得溶液的体积
A.大于20mL B.小于20mL C.等于20mL D.等于5mL
4.关于铝的性质,错误的说法是
A.铝的表面能形成致密的氧化膜,因此铝难腐蚀
B.铝能溶解于冷的浓硝酸,被氧化成硝酸铝
C.铝能溶解于NaOH溶液,生成偏铝酸钠和氢气
D.铝能在氯气中燃烧,生成三氯化铝
5. 下列金属冶炼的反应原理,错误的是
![]() A.2NaCl(熔融)
2Na+Cl2↑ B.MgO+H2
A.2NaCl(熔融)
2Na+Cl2↑ B.MgO+H2![]() Mg+H2O
Mg+H2O
![]() C.Fe3O4+4CO 3Fe+4CO2 D.2HgO
C.Fe3O4+4CO 3Fe+4CO2 D.2HgO ![]() 2Hg + O2↑
2Hg + O2↑
6.下列实验现象描述不正确的是
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.把铁片插入硫酸铜溶液中,铁片表面附着一层红色的物质
C.把铜片插入氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
7.常温下,下列溶液中即能溶解铁又能溶解铜的是
A.稀硝酸 B.浓硝酸 C.浓盐酸 D.浓硫酸
8.若溶液中由水电离产生的c(H+)=1×10-14 mol/L,满足此条件的溶液中一定可以大
量共存的离子组是
A.Al3+、Na+、NO![]() 、Cl- B. K+、NH
、Cl- B. K+、NH![]() 、SO
、SO![]() 、NO
、NO![]()
C.K+、Na+、Cl-、S2- D. K+、Na+、Cl-、NO![]()
9.下列各溶液中,pH最大的是
A.pH=5的盐酸溶液稀释1000倍
B.pH=9的烧碱溶液稀释1000倍
C.pH=9的氨水稀释1000倍
D.pH=4的盐酸溶液与pH=10的烧碱溶液等体积混合
10.可逆反应:A+3B![]() 2C+2D(各物质均为气体)在不同情况下测得有下列4 种反
2C+2D(各物质均为气体)在不同情况下测得有下列4 种反
应速率,其中反应最快的是
A.u D=0.4 mol / (L·s) B.u C=0.5 mol / (L·s)
C.u B=0.6
mol / (L·s)
D.![]() A=0.15
mol / (L·s)
A=0.15
mol / (L·s)
11.一定温度下,在固定容积的密闭容器中,可逆反应:
m A(g)+ nB(g) ![]() pC(g) + qD(g)
pC(g) + qD(g)
当m、n、p、q为任意正整数时,下列状态一定能说明反应已达到平衡的是
①体系的压强不再发生变化
②体系的密度不再发生变化
③各组分的物质的量浓度不再改变
④各组分的质量分数不再改变
⑤反应速率VA:VB:VC:VD = m:n:p:q
A.只有③④ B.②③④ C.①②③④ D.①②③④⑤
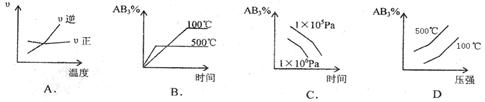
12.对于可逆反应2AB3(g)![]() A2(g)+3B2(g)(正反应吸热),下列图像正确的是
A2(g)+3B2(g)(正反应吸热),下列图像正确的是
13.下列各溶液中,微粒的物质的量浓度关系正确的是
A.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+) > c(NO3-)
B.1.0 mol/LNH4Cl溶液:c(NH4+)= c(Cl-)
C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:
c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.1.0 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
14.原电池的电极名称和电极反应不仅与电极材料有关,也与电解质溶液有关。下列说
法不正确的是
A.由Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3e- =Al3+
B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e- +4OH- =
AlO![]() +2H2O
+2H2O
C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e- = Cu2+
D.由Ag、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e- = Cu2+
15.下面的反应方程式配平后,该反应中电子转移总数是
KMnO4+ H2S+ H2SO4= K2SO4+ MnSO4+ S↓+
A.5 B.10 C.20 D.40
16.由锌、镁、铝、铁四种金属中的两种组成的混合物30 g,与足量盐酸反应产生的氢
气在标准状况下体积为11.2 L,则混合物中一定含有的金属
A.锌 B.镁 C铝 D.铁
第I卷答题处:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | ||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
高中二年级 化学
| 题号 | 第I卷总分 | 第Ⅱ卷 | 第Ⅱ卷总分 | 全卷 总分 | |||||
| 17 | 18 | 19 | 20 | 21 | 22 | ||||
| 得分 |
|
|
|
|
|
|
|
|
|
第Ⅱ卷 (非选择题 共52分)
(本卷共6小题)
17.(7分)
在密闭容器中的可逆反应CO(g)+NO2(g)![]() CO2(g)+NO(g)
CO2(g)+NO(g)
(正反应为放热反应)达到平衡后:
(1)扩大容器体积,容器内压强 ,反应混合物颜色 ,平衡 ;
(2)升高温度,平衡 ,混合气体分子总数 ;
(3)加入催化剂,NO的物质的量 ,原因是 。
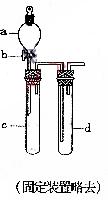 18.(8分) 某兴趣小组设计出如右图所示装置来改进教材中“铜与硝酸反应”的实验,以探究化学实验的绿色化。
18.(8分) 某兴趣小组设计出如右图所示装置来改进教材中“铜与硝酸反应”的实验,以探究化学实验的绿色化。
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c。其目的是 ;
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入3mL浓硝酸。c中反应的化学方程式是: ;
再由a向c中加5mL蒸馏水,此时c中反应的离子方程式是: ;
(3)下表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是(填方案序号)
,理由是 。
| 方案 | 反应物 |
| ① | Cu、浓HNO3 |
| ② | Cu、稀HNO3 |
| ③ | Cu、O2、稀HNO3 |
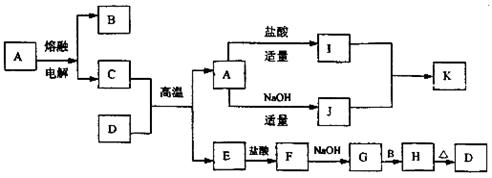 19.(9分)A~K均为中学化学中常见物质,其转化关系如图所示。A为金属氧化物,D为红棕色粉末,K为白色胶状沉淀(图中部分反应条件及反应物或产物未注明)。试填写下列空白:
19.(9分)A~K均为中学化学中常见物质,其转化关系如图所示。A为金属氧化物,D为红棕色粉末,K为白色胶状沉淀(图中部分反应条件及反应物或产物未注明)。试填写下列空白:
(1) 写出下列物质的化学式A ,D ;
(2) C与D的混合物通常称 ;
(3) 写出下列化学方程式或离子方程式:
A ®J (离子方程式) ;
G+B ® H (化学方程式) ;
(4) I的溶液通常显酸性,请用离子方程式解释原因 。
20.(10分)A、B、C、D、E、F六种主族元素分布在三个不同的短周期,它们的
原子序数依次增大,其中B与C同周期,A与D、C与F分别在同一主族,A、D两元素的原子核内的质子数之和是C、F两元素原子核内质子数之和的一半。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体,B、C的常见单质都是空气的主要成分,E是金属元素,但能表现出一些非金属元素的性质。请回答下列问题:
(1)写出B原子的电子式 ;画出D的原子结构示意图 ;
(2)由A、C两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X的结构式为______________,其分子属于___________(填“极性”、“非极性”)分子;
(3)写出单质E与氧氧化钠溶液反应的离子方程式_____________________________;
(4)一定条件下,B的最高价氧化物的水化物的浓溶液与红热的木炭反应,则该反
应的化学方程式 ;
(5)在10 L的密闭容器中,通入2 molFC2气体和3 mol C2气体,在一定条件
下反应生成FC3气体。当反应达到平衡时,C2的浓度为0.21 mol·L-1,则平衡时FC2的转化率为 。
21.(10分)某无色溶液含有Na+、Ba2+、Cu2+、SO32-、S2-、HCO3-、Cl-、AlO2-、
Br-等离子中的若干种。依次进行下列实验,现象如下:
① 用pH试纸检验,溶液的pH>7;
② 向溶液中滴加氯水,滴加过程中一直无气体、无沉淀产生,再加入CCl4振荡、
静置,CCl4层显橙红色,后用分液漏斗分液;
③ 向②分液后所得的水溶液中加入Ba(NO3 )2-HNO3混合溶液,除有白色沉淀生成
外无其它变化,然后过滤;
④ 向③滤液中加入AgNO3-HNO3混合溶液,有白色沉淀产生。
请回答下列问题:
(1)原溶液中肯定存在的离子有 ;
(2)原溶液中肯定不存在的阳离子有 ,
不存在的阴离子有 ;
(3)写出③中发生反应的离子方程式: 。
22.(8分)常温下,将10 mL 0.2 mol/LCH3COOH溶液与10 mL 0.1 mol/L NaOH溶
液混合得X溶液(忽略混合后溶液体积的变化)。试回答以下问题:
(1)X溶液的pH 7(填大于、小于或等于,下同);写出所得溶液中溶质的化学式 ;
(2)若向X溶液中加入10 mL 0.1 mol/L NaOH溶液,溶液的pH 7,原因是
;
(3)若向X溶液中滴加0.1 mol/L NaOH溶液至pH=7,则所得溶液中存在离子的离子浓度的关系为 。
高二年级化学 参考答案
第I卷选择题 每小题3分,共48分。
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | A | C | A | B | B | C | A | D |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | C | B | A | B | D | C | B | A |
第II卷非选择题 含6小题,共52分。
17.(7分)(1)减小(1分) 变浅(1分) 不移动(1分);
(2) 逆向移动(1分) 不变(1分);
(3)不变(1分) 催化剂不影响反应进行的程度(1分)
18.(8分)(1)检查装置的气密性(1分)
(2)Cu + 4HNO3(浓)= Cu(NO3)2+2NO2↑+
2H2O (2分)
3Cu + 8H+ +
2NO3- = 3Cu2+ +
2NO↑+ 4H2O (2分)
(3)③(1分) 不产生有污染的氮氧化合物(1分) 消耗硝酸量最少(1分)
19.(9分)(1)Al2O3(1分) Fe2O3(1分); (2) 铝热剂(1分)
(3)Al2O3+2OH-=2 AlO2-+ H2O(2分) 4Fe(OH)2+O2+2H2O = 4Fe(OH)3 (2分)
(4)Al3++3H2O ![]() Al(OH)3+3H+ (2分)
Al(OH)3+3H+ (2分)
20.(10分)(1)![]() (1分)
(1分)![]() (1分)
(1分)
(2) H-O-O-H (1分) ; 极性(1分)
(3)2Al+2OH-+2H2O=2AlO2-+3H2↑(2分)
(4)C + 4HNO3(浓) ![]()
![]() CO2↑+ 4NO2↑+2H2O(2分)
CO2↑+ 4NO2↑+2H2O(2分)
(5)90% (2分)
21.(10分)(1)(2)小题每个离子各1分 ,共8分。
(1)Br-、 SO32-、Na+ (2)Cu2+ 、Ba2+ ; S2-、HCO3-、AlO2-;
(3)Ba2+ + SO42- = BaSO4↓ (2分)
22.(8分)(1)小于(1分);CH3COONa(1分)和CH3COOH(1分)
(2)大于(1分) CH3COOH与NaOH溶液恰好完全反应生成CH3COONa(1分),CH3COO-水解使溶液中的c(OH-)> c(H+)(1分)
(3)c(Na+ )+ c(H+)= c(CH3COO-)+ c(OH-) (1分)
c(Na+ )= c(CH3COO-)>c(H+)= c(OH-) (1分)