高二化学学业水平(必修)模拟试题4
说明:本卷满分为100分,考试时间为75分钟
相对原子质量:C-12 H-1 N-14 O-16 K-39 Cl-35.5 Sn-119
一、选择题(每题只有一个选项符合要求,每题3分,共51分)
1、下列物质中,能够导电的是
A、二氧化碳 B、稀盐酸 C、蔗糖 D、硫酸铜晶体
2、通常浓硝酸不具有的性质是:
A. 强酸性 B. 脱水性 C. 氧化性 D. 挥发性
3、下列化学药品的安全警示性标注正确的是
A.浓硫酸—剧毒品 B.白磷—爆炸品
C.酒精—易燃品 D.碳酸钠—腐蚀品
4、偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生的巨大能量可作为航天运载火箭的推动力。下列叙述正确的是
A、偏二甲肼(C2H8N2)的摩尔质量为60g
B、6.02×1023个偏二甲肼(C2H8N2)分子的质量为60g
C、1mol偏二甲肼(C2H8N2)的质量为60g/mol
D、6g偏二甲肼(C2H8N2)含有NA个偏二甲肼(C2H8N2)分子
5、下列物质的电子式正确的是

6、与酸碱均可以反应,并且均有气体生成的是:
A. NaHCO3 B. Al C. Al(OH)3 D. Mg
7、下列性质的比较,正确的是
A.酸性:H2SiO3 >H2CO3 B.碱性Mg(OH)2 >Al(OH)3
C.稳定性 Si H4 >PH3 D.原子半径N > C
8、下列除杂质选用试剂和主要操作都正确的是
| 物质 | 杂质 | 试剂 | 主要操作 | |
| A | SiO2 | Fe2O3 | 盐酸 | 过滤 |
| B | NaHCO3 | Na2CO3 | 盐酸 | 加热 |
| C | Fe | Al | 氢氧化钠 | 分液 |
| D | Fe(NO3)2 | Ba(NO3)2 | 硫酸 | 过滤 |
9、下列物质在一定条件下均能和铁反应,其产物中铁元素呈+3价的是
A.硫酸铜溶液 B.稀硫酸 C.氯气 D.浓盐酸
10、下列物质中,溶于水后可生成两种酸的是
A. Cl2 B. HCl C. SO2 D. CO2
11、下列溶液中的Cl-浓度与50ml 1mol/L 氯化铝溶液中的Cl-浓度相等的是
A.150mL1mol·L-1氯化钠溶液 B.75mL2mol·L-1氯化铵溶液
C.150mL3mol·L-1氯化钾溶液 D.75mL1mol·L-1氯化镁溶液
12、鉴别FeCl3溶液和Fe(OH)3胶体,下列方法中最简单有效的是
A.加入足量的NaOH溶液 B.加热煮沸
C.加入足量的盐酸 D.观察是否产生丁达尔现象(效应)
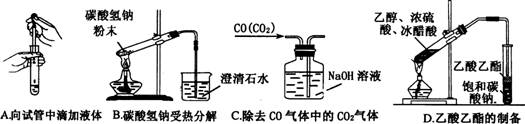
13、下列实验没有错误的是
14、1868年,俄国化学家门捷列夫制作出了第一张元素周期表,提示了化学元素间的内在联系,成为化学史上的重要里程碑之一。下列有关元素周期表的说法正确的是
A.元素周期表有七个周期
B.元素周期表有18个族
C.IA族的元素全部是金属元素
D.短周期是指第一、二、三、四周期
15、制备硅单质时,主要化学反应如下:
(1)SiO2 +2C
![]() Si +2CO↑ (2) Si + 2Cl2
Si +2CO↑ (2) Si + 2Cl2 ![]() SiCl4
SiCl4
(3)SiCl4 +
2H2 ![]() Si + 4HCl
Si + 4HCl
下列对上述三个反应的叙述中,不正确的是
A.(1)(3)为置换反应 B.(1)(2)(3)均为氧化还原反应
C.(2)为化合反应 D.三个反应的反应物中硅元素均被氧化
16、下列各组离子,能在溶液中大量共存的是
A Na+, Mg2+, Cl-, OH- B H+, Ca2+, CO32-, NO3-
C Cu2+, K+ , SO42-, NO3- D Na+, HCO3- , OH- , Ca2+
17、用30克乙酸和46克乙醇反应,如果实际产率是理论产率的67%,则可得到的乙酸乙酯的质量是
A、29.5克 B、44克 C、74.8克 D、88克
二、选择题(每题只有一个正确答案,每小题3分,共18分)
18、下列项目:①水温、②导电率、③PH、④固体悬浮物、⑤溶解氧(DO)、⑥化学需氧量(COD)、⑦生化需氧量(BOD)、⑧一些有毒有害物质的浓度等,其中属于评价水质优劣需要检测的项目是
A.③④⑤⑥⑦⑧ B.⑤⑥⑦⑧ C.④⑤⑥⑦⑧ D.①②③④⑤⑥⑦⑧
19、下列物质可用于自来水厂原水的消毒,但又不会造成环境污染的是
A.液氯 B.臭氧 C.酒精 D.醋酸
20、为保证加酶洗衣粉洗涤效果,应注意
A.使用沸水先冲泡洗衣粉 B.用含氯较高的自来水
C.和其他洗涤剂混合使用 D.室温时用水先溶解洗衣粉
21、下列说法中不正确的是
A.人体缺碘,可通过食用加碘盐补碘
B.缺铁性贫血,可通过食用铁强化酱油预防
C.为了防止龋齿,人人都要使用含氟牙膏
D.儿童缺锌可导致生长发育不良,抵抗力差,食欲不振
22、下列不属于蛋白质变性的是
A.往蛋白质溶液里加入食盐使之变浑浊
B.病人注射前用医用消毒酒精进行消毒
C.往蛋白质溶液中加入浓硝酸会出现沉淀
D.用福尔马林浸泡动物标本
23.下列用连线方法对部分化学知识进行归纳的内容中,有错误的组是
A、物质的性质与用途:
磺胺类药物能抑制细菌合成核酸――治疗肺炎、脑膜炎、尿路感染、呼吸道感染
酸能与碱中和-----胃酸过多的病人服用含氢氧化镁的药物
B、保护环境:
控制“白色污染”——禁止使用所有塑料制品
防止水的污染——提倡使用无磷洗衣粉
C、基本安全常识:
饮用假酒中毒――由甲醇引起
食用假盐中毒――由亚硝酸钠引起
D、生活中的一些做法:
除去衣服上的油污――可用汽油洗涤
使煤燃烧更旺――可增大煤与空气接触面积
三、(本题包括2小题,共10分)
24.(1)在食品中加入发色剂,它与食品中的某些成分发生化学反应,使成品呈现良好的色泽。如在肉类腌制加工过程中,加入硝酸盐和亚硝酸盐,使腌制好的肉类制品呈现鲜艳的红色。有关反应:亚硝酸根离子进入肉类,生成少量很不稳定的亚硝酸,亚硝酸分解生成硝酸、一氧化氮和水,一氧化氮与肌红蛋白(Mb)反应生成亮红色的亚硝基肌红蛋白(MbNO)。请写出相关反应的化学方程式或离子方程式。(写出一个就给分)
(2)过氧乙酸是一种常见的消毒剂,在2003年抗击“非典”的过程中,发挥了巨大的作用。过氧乙酸的分子构成比乙酸多一个氧原子,它具有特殊的过氧基“—O—O—”而表现出强的氧化性。在酸(如硫酸)的催化作用下,乙酸可被过氧化氢氧化为过氧乙酸,此过程是可逆反应。请写出该反应的化学方程式。
(3)一种二肽的结构简式为: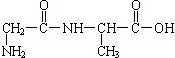 ,合成这种二肽的氨基酸是
,合成这种二肽的氨基酸是
,
(4)乙酰水杨酸(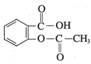 )的俗名为阿司匹林,是常用的解热镇痛药。它遇水能缓慢地水解生成水杨酸,则生成水杨酸的反应可表示为
。
)的俗名为阿司匹林,是常用的解热镇痛药。它遇水能缓慢地水解生成水杨酸,则生成水杨酸的反应可表示为
。
25.全世界每年因金属腐蚀造成的直接经济损失约达7000亿美元,我国因金属腐蚀造成的损失占国民生产总值的4%。
⑴请你根据不同原理,提出防止钢铁锈蚀的两条合理措施:
①
②
⑵请写出钢铁发生吸氧腐蚀时正极的电极反应式:
四、(本题包括三小题,共16分)
26、(5分)某学生设计了如下实验:
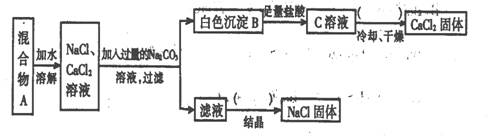 |
回答下列问题:
(1)该同学的实验目的是 ;
(2)上图括号内的操作步骤均为 ;
(3)按此实验方案得到的NaCl固体中肯定含有 (填化学式)杂质;为了解决这个问题可以向过滤得到的滤液中加入适量的 ;
(4)写出生成B的离子方程式 。
27.(5分)实验室欲配制80mL 2mol/L的KCl溶液,就配制该溶液的过程,请回答:
(1)不需要的仪器是 ;
A.烧杯 B.100mL容量瓶 C.量筒 D.胶头滴管 E.玻璃棒 F. 50mL容量瓶
(2)配制时应称取KCl g;
(3)下列操作的顺序是(用字母表示) ;
A.冷却 B.称量 C.洗涤 D.定容 E.溶解 F.摇匀 G.转移
(4)若容量瓶未干燥即用来配制溶液,实验结果将 ,若定容时俯视刻度线,实验结果将 。
28.(6分) X、Y、Z三种物质有如图所示转化关系:
(1)根据上述转化关系,写出下列物质的化学式: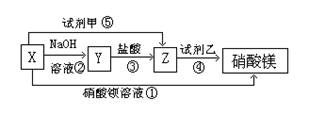 Z 、试剂乙
、X________________;
Z 、试剂乙
、X________________;
(2)写出上述各步反应①~⑤的离子方程式:
① ;
③___________ ;④ ;
五、(本题包括1小题,5分)
29、通过下列方法可以测定金属锡的纯度:
①将试样溶于盐酸中,发生的反应为:Sn+2HCl =SnCl2+H2 ↑
②加入过量的FeCl3溶液,发生的反应为:SnCl2 +2FeCl3 =SnCl4+2FeCl2
③用已知浓度的K2Cr2O7溶液滴定生成的Fe2+,发生的反应为:
6FeCl2 +K2Cr2O7 +14HCl =6FeCl3+2KCl +2CrCl3+7H2O
(1)上述氧化还原反应中,HCl 作氧化剂的是____________(填“①”、“②”或“③”)。
(2)现有金属锡样品0.613 g,经上述各步反应后,共用去0.100 mol/L K2Cr2O7溶液16.0 mL。求试样中锡的质量分数(假设杂质不参加反应)。
参考答案“
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | B | B | C | B | D | B | B | A |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | C | A | C | D | D | A | D | C |
| 题号 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | |
| 答案 | A | D | B | D | C | A | B |
24、(1)H+ + NO2-- = HNO2 ;3HNO2 = HNO3 + 2NO↑ + H2O ;Mb + NO = MbNO(2) CH3COOH+H2O2→CH3COOOH+H2O;
(3) 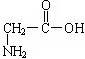 和
和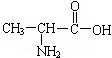
(4)
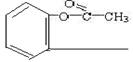 COOH +H2O →
COOH +H2O → ![]() +
+![]() H
H
25、①在钢铁表面增加一层涂层 ②改变钢铁的内部结构或制成合金(其它合理答案也可)O2+2H2O+4e=4OH-
26、(1)分离CaCl2和NaCl两种固体混合物; (2)蒸发
(3)Na2CO3 稀盐酸 (4)Ca2++CO32-=CaCO3↓
27、(1) F (C F) 。(2) 14.9 g。
(3) B E A G C (F) D F 。
(4) 无影响 , 偏大 。
28、(1)MgCl2、AgNO3、MgSO4
(2)Ba2++SO42-=BaSO4↓,Mg(OH)2+2H+=Mg2++2H2O,Ag++Cl-=AgCl↓
29、(1)① (2) 93.0%