 高二化学寒假
高二化学寒假
【主题】 高二化学期末寒假作业
寒假作业1
1、下列金属冶炼的反应原理,错误的是
A、2NaCl(熔融)![]() 2Na+Cl2↑ B、MgO+H2
2Na+Cl2↑ B、MgO+H2![]() Mg+H2O
Mg+H2O
C、Fe3O4+4CO![]() 3Fe+4CO2 D、2HgO
3Fe+4CO2 D、2HgO![]() 2Hg+O2↑
2Hg+O2↑
2、下表中物质的分类组合完全正确的是
| 编号 | A | B | C | D |
| 强电解质 | KNO3 | H2SO4 | BaSO4 | HClO4 |
| 弱电解质 | HI | CaCO3 | HClO | NH3·H2O |
| 非电解质 | SO2 | NH3 | Cl2 | 酒精 |
3、定向爆破建筑物时,应同时定向切断钢筋和炸碎水泥,除要用适宜的火药以外,还需用
A、氧炔焰 B、铝热剂 C、液氧 D、电弧
4、某温度下,浓度都是1mol/L的两种气体X2和Y2,在密闭容器中反应生成气体Z,达到平衡后,c(X2)为0.4mol/L,c(Y2)为0.8mol/L,生成的Z为0.4mol/L,则该反应式是
A、X2+2Y2![]() 2XY2
B、2X2+Y2
2XY2
B、2X2+Y2![]() 2X2Y
2X2Y
C、3X2+Y2![]() 2X3Y
D、X2+3Y2
2X3Y
D、X2+3Y2![]() 2XY
2XY
5、 下列各反应的化学方程式中,属于水解反应的是
A、H2O+H2O![]() H3O++OH-
B、HCO3-+OH-
H3O++OH-
B、HCO3-+OH-![]() H2O+CO32-
H2O+CO32-
C、CO2+H2O![]() H2CO3
D、CO32-+H2O
H2CO3
D、CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
6、下列事实可证明氨水是弱碱的是
A、氨水能跟氯化亚铁溶液反应生成氢氧化亚铁
B、铵盐受热易分解
C、0.1mol/L氨水可以使酚酞试液变红
D、0.1mol/L氯化铵溶液的pH约为5
7、一定温度下,可逆反应A2(g)+B2(g)![]() 2AB(g)达到平衡状态的标志是
2AB(g)达到平衡状态的标志是
A、单位时间内生成 n mol A2,同时生成 n mol AB
B、体系内的总压不随时间变化
C、单位时间内生成2n mol AB的同时生成n mol B2
D、单位时间内生成 n mol A2的同时,生成n mol B2
8、在一定温度下,将CO和水蒸气各1mol置于密闭容器中反应:CO+H2O![]() CO2+H2,达到平衡后测得CO2为0.6mol,再通入4mol水蒸气,达到新的平衡后CO2的物质的量是
CO2+H2,达到平衡后测得CO2为0.6mol,再通入4mol水蒸气,达到新的平衡后CO2的物质的量是
A、0.6mol B、大于0.6mol,小于1mol C、1mol D、大于1mol
9、把Ba(OH)2溶液滴入明矾溶液中,使SO42-全部转化成BaSO4沉淀,此时铝元素的主要存在形式是
A、Al3+ B、Al(OH)3 C、AlO2- D、Al3+和Al(OH)3
10、将0.l mol/L CH3COOH溶液加水稀释或加入少量CH3COONa晶体时,都会引起
A、溶液的pH增加 B、CH3COOH电离程度变大
C、溶液的导电能力减弱 D、溶液中c(OH-)减小
11、pH为2的盐酸和pH为11的NaOH溶液恰好完全反应时,二者的体积比为
A、1:1 B、10:1 C、1:10 D、1:100
12、将相同质量的镁条分别在①氧气中 ②空气中 ③氮气中 ④二氧化碳中完全燃烧后所得固体产物的质量的大小顺序是
A、②<①<③<④ B、④=①=②=③
C、③<②<①<④ D、③<①<②<④
13、下列事实不能用电化学理论解释的是
A、轮船水线以下的船壳上镶嵌有一定量的锌块
B、镀锌的铁制品比镀锡的铁制品耐用
C、铝片不用特殊方法保存
D、锌跟稀硫酸反应时,滴入少量硫酸铜溶液后,反应速率加快
14、将mg Al2O3、Fe2O3的混和物溶解在过量的100mLpH值为1的硫酸中,然后向其中加入NaOH溶液使Fe3+、Al3+刚好全部转化成沉淀,用去NaOH溶液100mL,则NaOH溶液的浓度为
A、0.1mol/L B、0.05mol/L C、0.2mol/L D、无法计算
15、相同物质的量浓度的NaCN和NaClO相比,NaCN溶液的pH较大,则同温同体积同浓度的HCN和HClO相比较,下列说法中正确的是
A、电离程度:HCN>HClO B、溶液的pH:HCN<HClO
C、与NaOH溶液恰好完全反应时,消耗NaOH的物质的量:HCN<HClO
D、酸根离子浓度: C(CN-)<C(ClO-)
16、在一个1L的密闭容器中,加入2molA和1molB,发生下述反应:
2A(g)+B(g)![]() 3C(g)+D(s),
3C(g)+D(s),
达到平衡时,C的浓度为1.2mol/L。若维持容器的体积和温度不变,反应从逆反应开始,按不同配比作为起始物质,达到平衡时,C的浓度仍是1.2mol/L,则D的起始物质的量应满足的条件应是
A、大于零即可 B、大于0.6mol C、大于或等于1mol D、任意值
17、某溶液中由水电离出来的氢离子浓度[H+]=1×10-14mol/L,在这种溶液里可能大量共存的离子组是
A、Al3+ NH4+ SO42- Cl- B、K+ Fe2+ MnO4- Cl-
C、NH4+ SiO32- NO3- K+ D、Na+ K+ AlO2- SO32-
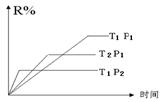 18、在密闭容器中进行下列反应:M(g) + N(g)
18、在密闭容器中进行下列反应:M(g) + N(g) ![]() R(g) + 2L
R(g) + 2L
此反应符合右图,下列叙述正确的是
A、正反应吸热,L是气体
B、正反应吸热,L是固体
C、正反应放热,L是气体
D、正反应放热,L是固体或液体
19、将铂电极放置在KOH溶液中,然后分别向两极通入CH4和O2即可产生电流,称为燃料电池。下列叙述正确的是
A、通甲烷的电极为正极
B、正极的电极反应式为:O2+2H2O+4e-=4OH-
C、通甲烷的电极反应式是:CH4+2O2+4e-=CO2+2H2O
D、负极的电极反应式是:CH4+10OH--8e-=CO32-+7H2O
20、向50mL 1mol/L AlCl3溶液中加入1.5mol/L NaOH溶液amL,充分反应后,生成的沉淀为0.02mol,则a的数值可能是
A、40 B、65 C、90 D、120
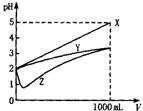 21、pH=2的X、Y、Z三种酸溶液各1 mL,分别加水稀释到1000 mL,其pH与溶液体积(V)的关系如下图所示,下列说法中正确的是
21、pH=2的X、Y、Z三种酸溶液各1 mL,分别加水稀释到1000 mL,其pH与溶液体积(V)的关系如下图所示,下列说法中正确的是
A、三种酸溶液的浓度:c(Z)>c(Y)>c(X)
B、三种酸中只有Z是弱酸
C、pH=2时,X、Y、Z都是稀溶液
D、稀释后三种酸中c(H+):X>Y>Z
22、常温下将稀NaOH溶液和稀CH3COOH溶液混合,不可能出现的结果是
A、pH>7,且c(OH—)>c(Na+)> c(H+)>c(CH3COO—)
B、pH>7,且c(Na+)+c(H+)=c(CH3COO—)+c(OH—)
C、pH<7,且c(CH3COO—)>c(H+)>c(Na+)>c(OH—)
D、pH=7,且c(CH3COO—)>c(Na+)>c(H+)=c(OH—)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 |
|
|
|
|
|
|
|
|
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
|
|
|
|
|
|
|
|
| 题号 | 17 | 18 | 19 | 20 | 21 | 22 |
| |
| 答案 |
|
|
|
|
|
| ||
23、在密闭容器中进行可逆反应:CO(气)+NO2(气) ![]() CO2(气)+NO(气) (正反应放热),达到平衡后,只改变其中一个条件,对平衡的影响是:
CO2(气)+NO(气) (正反应放热),达到平衡后,只改变其中一个条件,对平衡的影响是:
(1)增大容器的体积,平衡 ,反应混合物的颜色 。
(2)通入CO2气体,平衡 ,反应混合物的颜色 。
(3)加入催化剂,平衡 。
24、X、Y、Z为常见的三种单质,常温下X是固体,Y是深红棕色液体,Z是无色气体。其反应关系如下图所示,其中B的溶液显强酸性。
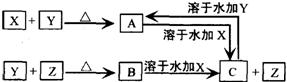
请回答下列问题:
(1)根据上述关系,确定X、Y、Z的化学式:
X ,Y ,Z 。
(2)X元素在元素周期表中的位置为 。
(3)写出A溶于水后加入X的离子方程式: 。
(4)写出C的溶液中通入过量氯气的离子方程式: 。
25、现有电解质溶液:①Na2CO3 ②NaHCO3 ③NaAlO2 ④CH3COONa ⑤NaOH,
且已知:CO2+3H2O+2AlO2-=2Al(OH)3↓+CO32-
(1)当五种溶液的pH相同时,其物质的量浓度由大到小的顺序是 ;
(2)将上述物质的量浓度均为0.1mol/L的五种溶液,稀释相同倍数时,其pH变化最大的是 ;
(3)在上述五种电解质溶液中,分别加入AlCl3溶液,无气体产生的是 。
(4)将上述①②③④这四种电解质溶液混合,发生反应的离子方程式为
________________________________。
26、图示装置可用来制取和观察Fe(OH)2在空气中被氧化时的颜色变化。实验时必须使用铁屑和6mol·L-1的硫酸,其他试剂任选。填写下列空白:
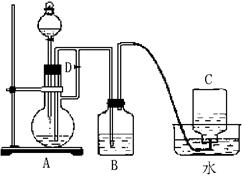
(1)B中盛有一定量的NaOH溶液,A中应预先加入的试剂是 。A中反应的离子方程式是 。
(2)实验开始时先应将活塞D (填“打开”“关闭”或“无关系”),C中收集到气体的主要成分是 。
(3)简述生成Fe(OH)2的操作过程
。
(4)拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式
。
27、在 2 L的密闭容器中充入 1 mol N2 和 3 mol H2,在一定的条件下反应,2 分钟后达到平衡状态,相同温度下,测得平衡时混合气体的压强比反应前混合气体的压强减小了 1/10,填写下列空白:
(1)平衡时混合气体中三种气体的物质的量比为 _________________。
(2)N2 的转化率为 _______________。
(3)2分钟内,NH3 的平均反应速率为 _____________________。
28、pH=12的NaOH溶液100mL,要使它的pH为11。(体积变化忽略不计)
(1)如果加入蒸馏水,应加 mL;
(2)如果加入pH=10的NaOH溶液,应加 mL;
(3)如果加0.01mol/L HCl,应加 mL。
答案:
1、B 2、D 3、B 4、C 5、D 6、D 7、C 8、B 9、C
10、A 11、C 12、C 13、C 14、A 15、D 16、B 17、AD
18、C 19、BD 20、AD 21、A 22、AD
23、(1)不移动,变浅;(2)向逆反应方向移动,变深;(3)不移动。
24、(1)Fe Br2 H2 (2)第四周期,Ⅷ族
(3)2Fe3++Fe=3Fe2+ (4)2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
25、(1)④>②>①>③>⑤ (2)⑤ (3)③④⑤
(4)HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-
26、(1)铁屑,Fe+2H+=Fe2++H2↑ (2)打开,H2
(3)关闭活塞D,使FeSO4溶液压入B瓶中进行反应
(4)4Fe(OH)2+O2+2H2O=4Fe(OH)3
27、(1) 2:6:1 (2)20% (3)0.1mol/(l﹒min)
28、(1)900 (2)1000 (3)81.8