 高二化学寒假
高二化学寒假
【主题】 高二化学期末寒假作业
寒假作业2
1.反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),在5L密闭容器中进行,半分钟后,NO的物质的量
4NO(g)+6H2O(g),在5L密闭容器中进行,半分钟后,NO的物质的量
增加了0.3mol,则此反应的平均速率为 ( )
A.V(O2)=0.01 mol/(L·S) B.V(NO)=0.008 mol/(L·S)
C.V(H2O)=0.003 mol/(L·S) D.V(NH3)=0.004 mol/(L·S)
2.在一定温度下,A2(g)+B2(g) ![]() 2AB(g)达到平衡的标志是 (
)
2AB(g)达到平衡的标志是 (
)
A.单位时间内减少x mol A2,同时生成2x mol AB
B.单位时间内生成x mol B2,同时生成x mol AB
C.单位时间内生成2x mol AB, 同时生成x mol A2
D.容器内压强不随时间变化而变化
3.下列事实中不能应用勒夏特列原理来解释的是 ( )
A.往硫化氢水溶液中加碱有利于S2-的增加 B.加入催化剂有利于氨氧化的反应
C.将反应混合物中的氨液化有利于合成氨的反应 D.高压有利于合成氨的反应
4.纯净的水呈中性,这是因为 ( )
A.纯水中[H+]=[OH-] B.纯水PH=7
C.纯水的离子积KW=1.0×10-14 D.纯水中无H+也无OH-
5.下列离子方程式正确的是 ( )
A. 碳酸钙和醋酸 CaCO3+2H+===Ca2++H2O+CO2↑
B. 碳酸氢钙溶液和足量氢氧化钠溶液 Ca2++HCO3-+OH-===CaCO3↓+H2O
C. 铜和稀硝酸反应 Cu+4H++NO3‑===Cu2++NO↑+2H2O
D. 硫酸铵溶液和氢氧化钠溶液共热 NH4++OH-![]() NH3↑+H20
NH3↑+H20
6.我国研制的磁谱仪已利用航天器送人太空,其目的是探索反物质的存在。反物质的主要特征是电
子带正电荷、质子带负电荷。则以下可表示反物质酸和反物质碱进行中和反应的实质的离子方程式
是 ( )
A.H— + OH+ == H2O B H+ + OH+ == H2O
C.H— + OH—== H2O D.H+ + OH— == H2O
7.下列物质的水溶液能导电,但属于非电解质的是( )
A.NaCl B.Cl2 C.Na2CO3 D.SO2
8.下列各反应的化学方程式中,属于水解反应的是( )
A. H2O+H2O![]() H3O++OH‐
B. HCO3-+OH‐
H3O++OH‐
B. HCO3-+OH‐![]() H2O+CO32-
H2O+CO32-
C. CO2+H2O![]() H2CO3
D. CO32-+H2O
H2CO3
D. CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
9.在Na2S溶液中,下列等式不正确的是( )
A.2c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-)
B.c(Na+)+c(H+)=2 c(S2-)+c(HS-)+c(OH-)
C.c(H+)+c(HS-)+2c(H2S)= c(OH-)
D.c(Na+)=2c(S2-)+2c(HS-)+2c(H2S)
10.CH3COOH 溶液与NaOH 溶液反应,若反应后溶液的PH为7 ,那么( )
A.CH3COOH与NaOH的质量相等 B.CH3COOH与NaOH的物质的量相等
C.NaOH过量 D.CH3COOH过量
11.0.1mol/L K2CO3 溶液中,由于CO32- 的水解,使得c(CO32-)< 0.1mol/L ,如果要使c(CO32-)
更接近于0.1mol/L,可以采取的措施是( )
A、加入少量盐酸 B、加入适量水 C、加入适量KOH D、加热
12.NO和CO都是汽车尾气里的有害物质,它们能缓慢地起反应生成N2 和CO2 ,对此反应下列叙述
中正确的是( )
A.使用催化剂不能改变反应速率
B.降低压强能使反应速率加快
C.改变压强对反应速率没有影响
D.升高温度能加快反应速率
13.某无色溶液加入铝可以生成氢气,则在该溶液中可能大量存在的离子组是( )
A. K+、Cu2+、NO3—、Cl— B. Ba2+、K+、SO42—、Cl—
C. NH4+、K+、HCO3—、Cl— D. Na+、Ba2+、Br—、Cl—
14.在0.1mol·L-1 CH3COOH溶液中存在电离平衡CH3COOH![]() CH3COO-+H+,当加入下列物质时
CH3COO-+H+,当加入下列物质时
可使其电离程度和PH都减小的是 ( )
A.CH3COONa浓溶液 B.NH3·H2O
C.浓盐酸 D.H2O
15.把镁粉中混有的少量铝粉除去,应选用的试剂是( )
A.稀盐酸 B.新制氯水 C.烧碱溶液 D.纯碱溶液
16.下列能大量共存于溶液中的一组离子是:( )
A. Fe3+ 、K+ 、SCN- 、SO42- B. Na+ 、Fe3+ 、NO3- 、Cl-
C. Mg2+ 、Fe2+ 、OH- 、NO3- D. Fe3+ 、Fe2+ 、H+ 、NO3-
17.当可逆反应:2SO2+O2![]() 2SO3已达到化学平衡时,充入少量18O2,一段时间后测定18O可能
2SO3已达到化学平衡时,充入少量18O2,一段时间后测定18O可能
存在于 ( )
A. O2中 B. O2和SO3中 C. SO2和SO3中 D. SO2、O2、SO3中
18. 下列有关滴定操作的顺序正确的是( )
①用标准溶液润洗滴定管 ②往滴定管内注入标准溶液 ③检查滴定管是否漏水④滴定 ⑤洗涤
A.⑤①②③④ B.③⑤①②④ C.⑤②③①④ D.②①③⑤④
19. 下列图中,能表示将 Ba(OH)2 溶液逐滴加入到Al2(SO4)3 溶液中,产生沉淀的质量W g与加入Ba(OH)2 溶液的体积V mL关系的是:( )
![]() W/g
W/g
W/g
W/g
W/g
W/g
W/g
W/g
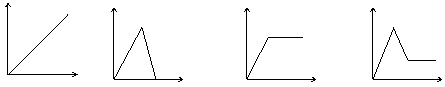 |
V/mL V/mL V/mL V/mL
A B C D
20. 5.1 g镁铝合金投入到500 m L 2 mol/L盐酸中,完全反应后,再加入4 mol/L氢氧化钠溶液。若沉淀质量达到最大值,则加入氢氧化钠溶液体积为 :( )
A.250 m L B.425 m L C.500 m L D.560 m L
21. 用于飞机制造业的重要材料是 ( )
A. Mg-Al合金 B. Cu-Sn合金 C. Al-Si合金 D. 不锈钢
22. 检验实验室配制的FeCl2溶液是否氧化变质,应选用的最适宜的试剂是( )
A. 稀硝酸 B.KSCN溶液 C.溴水 D.酸性KMnO4溶液
23. 为了使Fe(OH)2氧化成Fe(OH)3而不引入杂质,应向悬浊液中加入( )
A.氯水 B.浓硝酸 C.过氧化钠 D.过氧化氢
24. 一定质量的镁和铝的混合物,分成四等份,分别与足量的下列四种物质反应,充分反应后,放出氢气最多的是( )
A. 3 mol·L-1盐酸 B. 4 mol·L-1硝酸溶液
C. 8 mol·L-1烧碱溶液 D. 18.4 mol·L-1硫酸溶液
25.盐类水解的实质是盐电离出来的离子与 H2O 电离出来的 H+ 或 OH- 结合生成_________,从而
破坏了水的_________,使溶液显示出不同程度的_______.盐类的水解可看作是酸碱中和反应的
_______
26.Na2CO3 溶液中滴加酚酞呈红色,原因是(用离子方程式表示)__________
27.将0.02 mol·L-1的HCN与0.02 mol·L-1的 NaCN 溶液等体积混合,已知该混合溶液中
c(Na+)>c(CN-),用“>、<或=”填空.
(1) c(OH-)_____c(H+) (2) c(HCN)_____c(CN-)
(3) c(HCN)+ c(CN-)______0.02 mol·L-1
28.完成下列化学方程式或离子方程式.
(1)__ Mg + __CO2 ---_______+_____ (2) __Al + __MnO2 ----_____+_____
(3) Al(OH)3 + 3H+ ===___________ (4) Al3+ +3 OH- ===_________
(5) Al3+ + 4OH- ===______________ (6) __Al3+ +__AlO2-+ __H2O ===_______
29.把 NH4Cl 晶体溶入水中,得到饱和 NH4Cl 溶液.若在该溶液中加入镁条,则观察到有气泡产生,
点燃有爆鸣声,此气体是_________, 产生该气体的原因是
_________________,_____________________ (用离子方程式表示),微热后,能放出有刺激性气味的气体,它能使湿润的红色石蕊试纸变蓝,该气体是_______ _,
产生该气体的原因是___________________________________________,
总的反应离子方程式是________________________ _____
30 在25℃时,有pH =x (x≤6)的盐酸和pH =y (y≥8)的NaOH溶液,取Vx L该盐酸同该NaOH溶液中和,需Vy L NaOH溶液,问:
(1) 若 x + y = 14 ,则Vx/Vy =____(填数值).
(2) 若 x + y = 13 ,则Vx/Vy =____(填数值).
(3) 若 x + y > 14 ,则Vx/Vy =________(填表达式),且Vx____Vy(填“>,< 或 =”).
31.在一定温度下,发生如下反应: N2 +3H2 ![]() 2NH3
2NH3
起始时充入的N2 和 H2 的物质的量分别是3.0 mol和6.0 mol,平衡时,生成NH3的物质的量是2.4 mol.已知容器的容积为5.0 L,试求:
(1) H2 的转化率.
(2) 平衡时混合气体中N2 的体积分数.
| 序号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 | C | C | B | A | D | A | D | D | A | D | C | D |
| 序号 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 |
| 答案 | D | C | C | B | D | B | D | A | A | B | D | A |
25. 弱电解质 电离平衡 酸碱性 逆反应
26. CO32-+H2OHCO3-+OH-
27. > > =
28. (有反应条件的要注明)
(1)2Mg +1CO2 ==2MgO+C (2)4Al +3MnO2==3Mn+3Al2O3
(3) Al(OH)3 +3H+ ===Al3++3H2O (4) Al3+ +3 OH- ===Al(OH)3↓
(5) Al3+ + 4OH- ===AlO2-+2H2O (6)1Al3+ +3AlO2-+ 6H2O ==4Al(OH)3↓
|
|
NH3 NH3·H2O==NH3↑+H2O Mg+2NH4+==Mg2++2NH3↑+H2↑
30.
(1)1 (2)1/10 (3)10x+y-14 >
31.(1)60% (2)27%