 高二化学寒假
高二化学寒假
【主题】 高二化学期末寒假作业
寒假作业3
1、为了客运安全,下列物质①硝铵②硫铵③氯化钾④过磷酸钙⑤氯酸钾⑥硝酸
钾⑦白磷⑧汽油,从化学性质上判断,由于易燃易爆不能带上火车的是 ( )
A、①②④⑥⑧ B、①⑤⑥⑦⑧
C、①③⑥⑦⑧ D、①②⑤⑦⑧
2.我国“神舟6号”宇宙飞船的运载火箭的推进剂引燃后发生剧烈反应,产生大量高温气体从火箭
尾部喷出。引燃后高温气体成分有CO2、H2O、N2、NO等,这些气体均为无色,但在卫星发射现
场看到火箭喷射出大量红烟,产生红烟的原因是( )
A. 高温下N2遇空气生成NO2 B. NO遇空气生成NO2
C.CO2与N2反应生成NO2 D. NO与H2O反应生成NO2
3.在NO2与水的反应中,NO2是 ( )
A、只是氧化剂 B、只是还原剂
C、既是氧化剂,又是还原剂 D、既不是氧化剂,又不是还原剂
4.实验室可用下图所示装置干燥、收集某气体R,并吸收多余的R,则R是( )
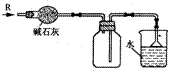 |
A.CH4 B.HCl C.Cl2 D.NH3
5.下列叙述中,能证明某物质是弱电解质的是( )
A. 熔化时不导电 B. 不是离子化合物,而是极性共价化合物
C. 水溶液的导电能力很差 D. 溶液中已电离的离子和未电离的分子共存
6. 下列电离方程式中正确的是( )
A. NH3·H2O
= NH4++OH- B. NaHCO3![]() Na+
+ HCO3—
Na+
+ HCO3—
C. H2CO3
= 2H++CO32- D.
HF + H2O ![]() F—
+ H3O+
F—
+ H3O+
7. 下列离子方程式中,能正确反映CH3COOH与NaOH反应的是( )
A. CH3COOH + Na+ + OH- = CH3COONa + H2O
B. CH3COOH + OH- = CH3COO- + H2O
C. H+ + OH- = H2O
D. CH3COO- + H+ + OH- = CH3COO- + H2O
8. 若溶液中由水电离产生的c(OH-)=1×10-14mol·L-1,满足此条件的溶液中一定可以大量共存
的离子组是( )
A. Al3+ Na+ NO-3 Cl- B. K+ Na+ Cl- NO3-
C. K+ Na+ Cl- AlO2- D. K+ NH+4 SO42- NO3-
9. 相同温度下等物质的量浓度的下列溶液中,pH值最小的是( )
A. NH4Cl B. NH4HCO3 C . NH4HSO4 D. (NH4)2SO4
10. 在48mL pH=1的HNO3溶液中加入12mL pH=13的 KOH溶液时,所得到的溶液呈( )
A. 酸性 B. 中性 C. 碱性 D. 无法确定
11. 在水中加入下列物质,可使水的电离平衡向电离方向移动的是( )
A. H2SO4 B. KOH C. FeCl3 D. Ba(NO3)2
12. 如图所示,反应X(g)+3Y(g)![]() 2Z(g)+热量,在不同温度、不同压强(P1>P2)下,
2Z(g)+热量,在不同温度、不同压强(P1>P2)下,
达到平衡时,混合气体中Z的质量分数Z%随温度变化的曲线,其中正确的是( )
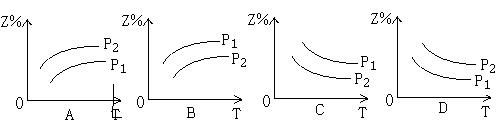 |
13. 氨水中存在下列平衡:NH3·H2O![]() NH4+
+ OH- 。若要使平衡向逆方向移动,同时使c(OH-)
NH4+
+ OH- 。若要使平衡向逆方向移动,同时使c(OH-)
增大,应加入的物质是( )
A. 氯化铵固体 B. 硫酸 C. 氢氧化钠固体 D. 液氨
14. 0.1 mol·L的NaOH溶液和0.1 mol·L 的NH4Cl溶液等体积混合后,离子浓度大小次序正确
的是( )
A. c(Na+)>c(Cl-)>c(OH-)>c(H+) B. c(Na+)=c(Cl-)>c(OH-)>c(H+)
C. c(Na+)=c(Cl-)>c(H+)>c(OH-) D. c(Cl-)>c(Na+)>c(OH-)>c(H+)
15.在10 mL 0.1 mol·L-1 NaOH溶液中加入同体积、同浓度的HAc溶液,反应后溶液中各粒子的
浓度关系错误的是( )
A. c(Na+)>c(Ac-)>c(H+)>c(OH-) B. c(Na+)>c(Ac-)>c(OH-)>c(H+)
C. c(Na+)>c(Ac-)>c(HAc) D. c(Na+)+c(H+)=c(Ac-)+c(OH-)
16. ![]()
![]() 一定温度下,反应2SO2 + O2
一定温度下,反应2SO2 + O2 ![]() 2SO3,达平衡时,n(SO2):n(O2):n(SO3)=2:3:4,缩小体积反
2SO3,达平衡时,n(SO2):n(O2):n(SO3)=2:3:4,缩小体积反
应再次达到平衡时,n(O2)=0.8mol, n(SO3)=1.4mol此时SO2的物质的量应是:( )
A.0.4mol B.0.6mol C.0.8mol D.1.2mol
17. 下列事实中不能应用勒沙特列原理来解释的是 ( )
A. 往硫化氢水溶液中加碱有利于S2- 的增多
B.加入催化剂有利于氨氧化的反应
C.高压有利于合成氨的反应
D.及时分离出氨气有利于合成氨的反应
18. 实验测得常温下0.1mol/L某一元酸(HA)溶液的pH不等于1, 0.1mol/L某一元碱 (BOH)溶液里
c(H+)/c(OH-)=10-12,将这两种溶液等体积混合后,所得溶液里各离子的物质的量浓度由大到小顺序
是( )
A. c(B+)>c(A-)>c(OH-)>c(H+) B. c(A-)>c(B+)>c(H+)>c(OH-)
C. c(B+)=c(A-)>c(H+)=c(OH-) D. c(B+)>c(A-)>c(H+)>c(OH-)
19. 在室温下等体积混合的酸和碱的溶液,混合后pH<7的是( )
A. pH=3的硝酸和pH=11的氢氧化钾溶液 B. pH=3的盐酸和pH=11的氨水
C. pH=3的醋酸和pH=11的氢氧化钡溶液 D. pH=3的硫酸和pH=11的氢氧化钠溶液
20. 将20mL0.4mol/L硝酸铵溶液跟50mL0.1mol/L氢氧化钡溶液混合,则混合液中微粒浓度关系正
确的是( )
A. c(NO3-)>c(OH-)>c(NH4+)>c(Ba2+)
B. c(NO3-)>c(Ba2+)>c(NH4+)>c(OH-)
C. c(Ba2+)> c(NO3-)>c(OH-)>c(NH4+)
D. c(NO3-)>c(Ba2+)>c(OH-)>c(NH4+)
21.下列叙述中,正确的是( )
A含金属元素的离子一定是阳离子
B金属离子只能被还原,不能被氧化
C金属氧化物不一定都是碱性氧化物
D金属元素在化合物中既可显正价也可显负价
22.下列各组有机化合物中,肯定属于同系物的一组是 ( )
A.C3H6与C5H10 B.C4H6与C5H8
C.C3H8与C5H12 D.C2H2与C6H6
23.下列有机物中命名不正确的是
A. 2-甲基丁烷 B. 1,2-二甲基戊烷
C. 2,2-二甲基戊烷 D. 2-甲基-4-乙基庚烷
24.两种气态烃组成的混合物共0.1mol,完全燃烧后得到3.85LCO2(标准状况)和
3.6g水,下列说法正确的是
A.一定有甲烷 B.一定有乙烷
C.一定有乙烯 D.一定有乙炔.
25.在一固定容积的密闭容器中,充入2molA和1molB发生反应:2A(气)+B(气)=xC(气)
达到平衡后,C的体积分数为W%。若维持容器体积和温度不变,按0.6molA,0.3molB和1.4molC)
为起始物质,达到平衡后,C的体积分数也为W%,则x的值为 ( )
A.1 B.2 C.3 D.4
26.若1 mol某气态烃CxHy完全燃烧,需用3 mol O2,则
A.x = 2,y =2 B.x = 2,y =4
C.x = 3,y =6 D.2=3,y=8
27.右图中,锥形瓶内盛有气体X,滴管内盛有液体Y,若挤压滴管胶头,使
液体Y滴入瓶中,振荡,一会儿可见小气球a鼓气。下列叙述中正确的是
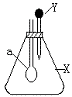 A、X是NH3,Y是浓氨水
A、X是NH3,Y是浓氨水
B、X是SO2,Y是NaOH浓溶液
C、X是CO2,Y是稀硫酸
D、X是NO,Y是NaOH稀溶液
28.工业上用铜屑和浓硝酸为原料制取硝酸铜,在实际生产中,需把浓硝酸用等体积水稀释。试简答:
(1)用稀硝酸而不用浓硝酸的原因:
(2)写出Cu与浓、稀硝酸两个反应的方程式:
; 。
(3)从经济效益和环保角度考虑、设计制取硝酸铜最适宜方法,用化学方程式表示为:
。
29.提示:某些金属氧化物跟熔融烧碱反应可生成盐,根据图2化学反应方框图填空:
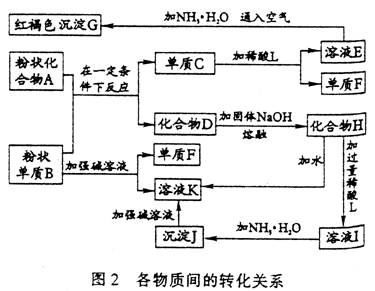
(1)单质F是________;
(2)写出由E生成G的离子方程式(或化学方程式)_______
;
(3)溶液I中所含金属离子是________;
30.某化学研究性学习小组对某无色溶液进行定性检验,已知该溶液由
Na+、Ag+、Ba2+、Al3+、AlO2-、MnO4-、CO32-、SO42-中的若干种组成。取该溶液进行如下实验:
Ⅰ:取适量试液,加入过量盐酸,有气体甲生成,并得到无色溶液;
Ⅱ:在Ⅰ所得溶液中再加入过量碳酸氢铵溶液,有气体甲生成,并析出白色沉淀乙;
Ⅲ:在Ⅱ所得溶液中加入过量Ba(OH)2溶液并加热,有气体丙和白色沉淀丁生成。
根据上述实验回答下列问题:
(1)由Ⅰ可推知原待检溶液中必定含有两种离子,它们的化学式为: ;
(2)由Ⅰ、Ⅱ可推知白色沉淀乙的化学式为: ;
(3)写出Ⅰ中产生气体甲的离子方程式: ;
(4)写出Ⅲ中产生气体丙的离子方程式: ;
(5)判断沉淀丁的成份的简单方法是: 。
31.将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2
混合气体在标准状况下的体积为11.2L。请回答:
(1)NO的体积为 L,NO2的体积为 L。
(2)待产生的气体全部释放后,向溶液加入![]()
![]() 的NaOH溶液,恰好使溶液
的NaOH溶液,恰好使溶液
中的![]() 全部转化成沉淀,则原硝酸溶液的浓度为
mol/L。(表达式)
全部转化成沉淀,则原硝酸溶液的浓度为
mol/L。(表达式)
32.恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,
发生如下反应: N2 (g) + 3 H2(g) ![]() 2NH3(g)
2NH3(g)
(1)若反应进行到某时刻t时,nt (N2) = 13mol,nt (NH3) = 6mol,计算a的值
(2)反应达平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为
25%。 计算平移时NH3的物质的量 mol。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始)∶n(平)= 。
(4)原混合气体中,a∶b = 。
(5)达到平衡时,N2和H2的转化率之比,![]() (N2)∶
(N2)∶![]() (H2)= 。
(H2)= 。
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 答案 | B | B | C | D | D | D | B | B | C | A | C | C | C | B | A |
| 题号 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | |||
| 答案 | A | B | A | C | D | C | C | B | A | B | B | B |
28.(1)因为铜和浓硝酸反应会放出二氧化氮污染环境,且制取等量的硝酸铜耗浓硝酸的量多
(2)Cu + 4HNO3(浓) = Cu(NO3)2 +2NO2↑+ 2H2O ,
3Cu + 8HNO3(稀) = 3Cu(NO3)2 +2NO↑+ 4H2O
![]() (3)2Cu +O2 △
2CuO, CuO + 2HNO3 ═ Cu(NO3)2 +H2O
(3)2Cu +O2 △
2CuO, CuO + 2HNO3 ═ Cu(NO3)2 +H2O
29.(1) H2 (2)Fe2+ + 2NH3.H2O ═ Fe(OH)2↓+2NH4+
4Fe(OH)2 +2H2O+O2 =4Fe(OH)3 (3)Al3+
30.
![]() (1): Na+ 、CO32— ; (2) Al(OH)3 ;
(1): Na+ 、CO32— ; (2) Al(OH)3 ;
(3) 2H+ + CO32— = H2O + CO2↑。(4) NH4+ + OH— = NH3 ↑ + H2O
(5)判断沉淀丁的成份的简单方法是:取少量沉淀,加入足量稀盐酸,若沉淀全部溶解,说明是BaCO3;若部分溶解,说明是BaCO3和BaSO4的混合物 。
31.(1)5.824 L ,5.376L ,(2)![]()
32. ⑴a = 16 ⑵ 8mol ⑶5∶4 ⑷2∶3 ⑸1∶2