高二化学下学期期中考试卷
 高二化学【实验班】
高二化学【实验班】
命题:李昌德
注意事项:1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共四大题23个小题。
考试时间90分钟,满分108分。
2.认真分析,仔细审题;答题要求规范,卷面整洁。
3.务必在第II卷在指定的地方写姓名、考生号,并必须用黑色字迹的钢笔或签字笔作答,选择题答案写在题号后答题框内. 非选择题答案直接写在题卷上.( 即各题目指定区域内相应位置上)。
4.可能用到的相对原子质量:H:1 C:12 O:16 S:32 N:14 Cl:35.5 Br:80
第I卷(选择题,共48分)
一、选择题(本题包含16个小题,每小题3分,共48分。每小题只有一个选项符合题意。)
1、2007年10月10日德国格哈德·埃特尔因在表面化学研究领域作出开拓性贡献而获得诺贝尔化学奖。在物质表面所发生的一切物理化学现象称为表面现象,而研究各种表现现象实质的科学称为表面化学。表面活性剂指活跃于表面和界面上具有极高的降低表面、界面张力的能力的一类物质。α-烯基磺酸钠是一种常见的表面活性剂, 其结构简式为RCH=CH(CH2)nSO3Na,常用作洗涤剂,有关其叙述正确的是 ( )
A、α-烯基磺酸钠难溶于水 B、α-烯基磺酸钠中“-SO3Na ”为憎水基
C、α-烯基磺酸钠水溶液显酸性 D、α-烯基磺酸钠能使溴水褪色
2、下列有关化学用语正确的是 ( )
A.乙醇、乙二醇、丙三醇互为同系物,同系物之间不可能为同分异物体
B.2008年北京奥运会奖牌——“金镶玉”奖牌玉的化学成分多为含水钙镁硅酸盐,如:Ca2Mg5Si8O22(OH)2可用氧化物表示为:2CaO·5MgO·8SiO2·H2O
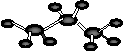 C.次氯酸的结构式为:H—Cl—O
C.次氯酸的结构式为:H—Cl—O
D.丙烷分子的比例模型示意图:
3、现有下列物质:①纤维素 ②甲酸甲酯 ③淀粉 ④甲醛 ⑤丙酸 ⑥乳酸(α—羟基丙酸)
⑦乙二醇 ⑧乙酸。其中,符合Cn(H2O)m的组成,但不属于糖类的是 ( )
A.②③④ B.①③④⑦ C.②④⑥⑧ D.②④⑤⑧
4、下列说法中错误的是: ( )
①化学性质相似的有机物是同系物
②分子组成相差一个或几个CH2原子团的有机物是同系物
③若烃中碳、氢元素的质量分数相同,它们必定是同系物
④互为同分异构体的两种有机物的物理性质有差别,但化学性质必定相似
A. ①②③④ B. 只有②③ C. 只有③④ D. 只有①②③
5、乙醇分子中各化学键如图所示,对乙醇在各种反应中应断裂的键说明不正确的是
A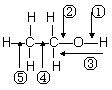 .和金属钠作用时,键①断裂
.和金属钠作用时,键①断裂
B.和浓硫酸共热至170 ℃时,键②和⑤断裂
C.和乙酸、浓硫酸共热制乙酸乙酯时,键②断裂
D.在铜催化下和氧气反应时,键①和③断裂
6、在医学、日常生活中常见的溶液:①福尔马林 ②医用消毒酒精 ③生理盐水 ④食醋;这些溶液中的溶质质量分数由大到小顺序为 ( )
A.①②③④ B.①②④③ C.②④①③ D.②①④③
7、下列说法中正确的是 ( )
A.只由一种元素组成的物质一定是纯净物
B.离子晶体中既可能存在离子键也可能存在共价键,分子晶体一定存在共价键
C.原子晶体中共价键越强,熔点越高
D.Na2O2、H2O2、CaC2、CO2中均含有非极性键
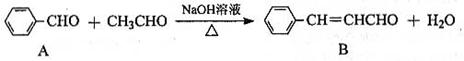
8、 肉桂醛是一种实用香精, 它广泛用于牙膏、洗涤剂、糖果以及调味品中。工业上可通过下列反应制备:
|
下列相关叙述正确的是( )
①B的相对分子质量比A大28 ②A、B可用酸性高锰酸钾溶液鉴别
③B中含有的含氧官能团是醛基、碳碳双键 ④A、B都能发生加成反应、还原反应
⑤A能发生银镜反应 ⑥B的同类同分异构体(含苯环、包括B)共有5种
⑦A中所有原子一定处于同一平面
A.只有③④⑤ B.只有④⑤⑥
|
9、以下对生活事实的解释,不正确的是( )
A.厨房里洗涤油污,常用碱性洗涤剂,因为植物油会在碱性溶液中水解
B.食品添加剂虽然能改善食物的色、香、味,但由于他们对健康有害,均不宜食用
C.用灼烧的方法可以区别人造丝和蚕丝,因为蚕丝是蛋白质,被灼热时会产生具有烧焦羽毛的气味
D.高温消毒是通过加热的方法使细菌的蛋白质变性而死亡
10、(2007年高考理综四川卷,周期表、结构)短周期元素W、X、Y、Z的原子序数依次增大,W与Y、X与Z位于同一主族,W与X可形成共价化合物WX2,Y原子的内层电子总数是其最外层电子数的2.5倍。下列叙述中不正确的是( )
(A)WZ2分子中所有原子最外层都为8电子结构
(B)WX2、ZX2的化学键类型和晶体类型都相同
(C)WX2是以极性键结合成的非极性分子
(D)原子半径大小顺序为X<W<Y<Z
11、下列有关化学实验的操作或说法中,不正确的是( )。
①医疗上判断糖尿病患者病情的方法可用新制的Cu(OH)2来测定患者尿液中葡萄糖的含量
②在进行硫酸铜晶体里结晶水含量的测定实验中,称量操作至少要进行4次
③检验溴乙烷中的溴元素时,将溴乙烷和氢氧化钠溶液混合加热后,加入稀H2SO4进行酸化
④将铜丝在酒精灯外焰上加热变黑后,再移至内焰铜丝又恢复到原来的红色
⑤ 盛放过苯酚的试剂瓶中残留的苯酚,用酒精洗涤
⑥用加酶洗衣粉在温水中不能洗涤毛料服装
⑦将淀粉水解,并用新制的氢氧化铜检验其水解产物的实验中,要进行的主要操作是:先滴加稀硫酸
后加热,又滴加新制的氢氧化铜悬浊液,再加热。
A、①③④ B、②③④⑥ C、③⑦ D、②③④⑤
12.除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验
目的的是 ( )
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 甲烷(甲醛) | 水、浓硫酸 | 洗气 |
| C | 福尔马林(蚁酸) | 饱和碳酸钠溶液 | 分液 |
| D | 溴化钠溶液(碘化钠) | 溴的CCl4溶液 | 蒸馏 |
13、下列各项所述的数字不是6的是 ( )
A.在NaCl晶体中,与一个Na+最近的且距离相等的Cl-的个数
B.在金刚石晶体中,最小的环上的碳原子个数
C.在二氧化硅晶体中,最小的环上的原子个数
D.在石墨晶体的片层结构中,最小的环上的碳原子个数
14、有机物分子中的原子(团)之间会相互影响,导致相同的原子(团)表现不同的性质。下列各项的事实不能说明上述观点的是 ( )
A、甲苯能使酸性高锰酸钾溶液褪色,而甲基环己烷不能使酸性高锰酸钾褪色
B、乙烯能与溴水发生加成反应,而乙烷不能发生加成反应
C、苯酚与溴水可直接反应,而苯与液溴反应则需要铁作催化剂
D、苯与硝酸在加热时发生取代反应,甲苯与硝酸在常温下就能发生取代反应
15、下列化学方程式或离子方程式中正确的是 ( )
A、金属钠加入无水乙醇中:Na + C2H5OH → C2H5ONa + H2↑
B、过量的乙酸跟Na2CO3溶液反应:2H+ + CO32— = H2O + CO2↑
C、溴乙烷在NaOH水溶液中加热:CH3CH2Br + NaOH →CH2=CH2↑+NaBr + H2O
![]() D、苯酚钠溶液中通入CO2:
D、苯酚钠溶液中通入CO2:
16.某种高分子化合物的结构简式如图所示:
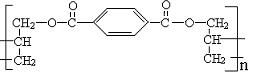
合成它的单体可能有:①对苯二甲酸,②对苯二甲酸甲酯,③丙烯醇,④丙烯,⑤乙烯。其中正确的一组是 ( )
A.①② B.④⑤ C.①③ D.②④
重庆市垫江师范2007—2008学年下学期期中考试卷
 高二化学【实验班】
高二化学【实验班】
高二年级化学试卷成绩统计表(考生不要填写)
| 题 号 | 一 | 二 | 三 | 四 | 五 | 总 分 | |||
| 17 | 18 | 19 | 20 | 21 | 22 | 23 | |||
| 得分 |
|
|
|
|
|
|
|
| |
第I卷答题栏
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 |
|
|
|
|
|
|
|
|
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
|
|
|
|
|
|
|
|
第Ⅱ卷(非选择题,共60分)
二、填空题(本题包括2小题,共19分).
17(12分)、
Ⅰ(2分).生的绿色苹果与碘变蓝色,这是因为__________________________________;
熟的苹果能与银氨溶液反应,原因是 ___________________________________。
Ⅱ.(6分)同族元素的同类物质的结构、性质既有相似性,也有特殊性。回答下列问题:
⑴ 已知酸性FCH2COOH>CH3COOH,试推断:
①BrCH2COOH、②ClCH2COOH、③FCH2COOH的酸性由强到弱的顺序(填序号)__________。
⑵ 已知AgCl可溶于稀氨水形成银氨溶液、AgBr可溶于浓氨水形成银氨溶液、AgI不溶于浓氨水,它们都不溶于水。试推断:上述三种银盐在水中溶解度由大到小的顺序________________________。
⑶ 除HF外,其他卤化氢沸点随相对分子质量增大而升高,HF的沸点反常的原因是___
_________________________________________________________。
Ⅲ.(每空1分,共4分)教材中学过的不同类的四种有机物,都能燃烧产生等体积的CO2和H2O(气),
(无其它产物),且又都能通过一步反应生成乙醇。请写出它们的结构简式:
⑴ ⑵
⑶ ⑷
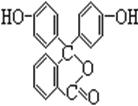 18、(7分)酚酞是常用的酸碱指示剂,其结构简式如右图
18、(7分)酚酞是常用的酸碱指示剂,其结构简式如右图
(1)酚酞的化学式为;_____ __。
(2)从结构上酚酞可看做 ________
A.烯烃 B.芳香族化合物 C.醇类物质
D.酚类物质 E. 羧酸类物质 F.酯类物质
(3)酚酞可分别在1 mol·L-1盐酸和1 mol·L-1NaOH溶液中溶解,其中在___ __中的溶解度较大,其原因是______ _ ________________________________。
三、推断题(共12分)
19、 (12分)有机物A、B、C互为同分异构体,分子式为C5H8O2,有关的转化关系如图所示,已知:A的碳链无支链,且1 mol A能与4 mol Ag(NH3)OH完全反应;B为五元环酯。
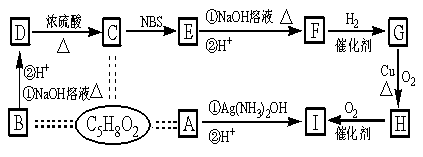
提示:CH3—CH=CH—R![]() CH2Br—CH=CH—R
CH2Br—CH=CH—R
(1)A中所含官能团是___________________。
(2)B、H结构简式为___________________________、___________________________________。
(3)写出下列反应方程式(有机物用结构简式表示)
D→C___________________________________________________;反应类型
E→F(只写①条件下的反应)______________________________________________。
(4)F的加聚产物的结构简式为______________________________。
(5)配制银氨溶液时,把氨水滴入硝酸银溶液的操作关键是:
_______________________
四、实验与探究题(本题包括2小题,共14分)
20.(2分)在实验室鉴定氯酸钾晶体和1-氯丙烷中的氯元素,现设计了下列实验操作程序:①滴加AgNO3溶液;②加入NaOH溶液;③加热;④加催化剂MnO2;⑤加蒸馏水过滤后取滤液;⑥过滤后取残渣;⑦用HNO3酸化。
(1)鉴定氯酸钾中氯元素的操作步骤依次是_______________ (填序号)
(2)鉴定1-氯丙烷中氯元素的操作步骤依次是_________________(填序号)
21(12分)某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫
酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。
已知①无水氯化钙可与乙醇形成难溶于水的CaCl2·6 C2H5OH
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
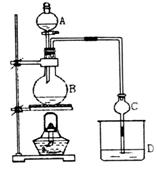 请回答:
请回答:
(1)浓硫酸的作用是 ;若用同位素18O示踪法确定反应产物水分子
中氧原子的提供者,写出能表示18O位置的化学
方程
式 ;
(2)在实验中球形干燥管C除起冷凝蒸气作用外,另一个重要作用是 ,
其原因是 。
若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程
式表示) ;
反应结束后D中的现象是 。
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和少量水,应先加入无水氯化钙,分离出 ;然后在混合液中加入 (此空从下列选项中选择),再加热进行蒸馏,收集77℃左右的馏分,以得一较纯净的乙酸乙酯。
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰
(4)饱和Na2CO3溶液的作用是 。
 五、计算题与填空(本题包括2小题,共15分)
五、计算题与填空(本题包括2小题,共15分)
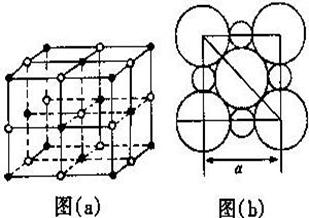
22、(9分)在离子晶体中,阴、阳离子按一定规律在空间排列, 右图(a)是NaCl的晶体结构,在离子晶体中,阴、阳离子具有或近似具有球形对称结构,它们可以被看作是不等径的刚性圆球,并彼此相切如NaCl晶体结构图(b),已知a为常数。
(1)在NaCl晶体中,每个Na+ 同时吸引 个Cl-;与某个Na+距离最近且等距离的Cl-围成的空间几何形状是 ;Na+ 数目和Cl-数目之比为 ;在 Na+周围与它最近且距离相等的 Na+共有 个。
(2)Na+ 半径与Cl-半径之比=
(已知![]() =1.414);
=1.414);
(3)NaCl晶体中不存在分子,但在1.013×105 Pa,1413 ℃时,NaCl晶体形成气体,并以分子形式存在。现有29.25克NaCl晶体,在1.013×105 Pa时强热使温度达到1501.5 ℃,测得气体体积为36.4 L,试应用有关物理、化学知识计算此时氯化钠气体的分子式(不写计算过程) ;
(4)纳米材料的表面原子占总原子数的比例极大,这是它具有许多特殊性质的原因,假设某氯化钠纳
米颗粒的大小和形状恰好等于氯化钠晶胞的大小和形状,则这种纳米颗粒的表面原子数与总原子数
和比值为 。
(5)若a=5.6×10-8 cm,求NaCl晶体的密度(已知5.6 3=175.6,NaCl的摩尔质量为58.5 g/mol)。
解:
23.(6分)某有机物含有C、H、O三种元素,其蒸气密度是相同条件下CH4密度的3.625倍,把1.16g该有机物在O2中充分燃烧,将生成物通过足量碱石灰,碱石灰增重3.72g,又知生成的CO2和H2O的物质的量之比为1:1。该有机物可以使溴水褪色,能和金属钠发生反应生成H2,
求:(1)该有机物的摩尔质量 ;
(2)该有机物的分子式 ;
(3)该有机物的结构简式
重庆市垫江师范2007—2008学年下学期期中考试卷
高二化学【实验班】
考试内容:烃的衍生物等与晶体
化学参考答案及评分标准
一、选择题(本题包含16个小题,每小题3分,共48分。每小题只有一个选项符合题意。)
1-8DBCA;CCDCB ;9-16BDCB;CBDC
二、填空题(本题包括2小题,共19分).
 17(12分)、
17(12分)、
17.Ⅰ(2分).生苹果中含大量的淀粉;熟苹果中淀粉水解生成葡萄糖。(各1分,共2分)
Ⅱ(每空2分,共6分)⑴ ③②① ⑵ AgCl>AgBr>AgI
⑶ HF分子间存在氢键,分子之间作用力大,沸点反常的高。
Ⅲ (每空1分,共4分)CH2=CH2 、 CH3CHO 、HCOOC2H5 、 CH2OH(CHOH)4CHO
18(7分)Ⅰ(1)C20H14O4 (1分) (2)BDF (3分) (3)1 mol·L-1NaOH溶液 酚类在强碱性条件下可生成易溶于水的盐,而且酯类物质在碱液中水解更彻底,溶解度更大(3分)
三、推断题(共12分)
19、 (12分)
[答案](1)醛基或—CHO。(1分) (2) 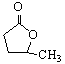 ;OHC—CH2—CH2—CH2—COOH。(各1分共2分)
;OHC—CH2—CH2—CH2—COOH。(各1分共2分)
(3)CH3CH(OH)CH2CH2COOH![]() CH3CH=CHCH2COOH+H2O;(2分)反应类型:消去反应(1分)
CH3CH=CHCH2COOH+H2O;(2分)反应类型:消去反应(1分)
BrCH2CH=CHCH2COOH+2NaOH![]() HOCH2CH=CHCH2COONa+NaBr+H2O。(2分)
HOCH2CH=CHCH2COONa+NaBr+H2O。(2分)
(4) 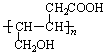 。(2分)
。(2分)
(5)边振荡边逐滴加入至白色沉淀恰好溶解为止。(2分)
三、实验与探究题(本题包括2小题,共14分)
20. (2分)(1)④③⑤⑦①(2)②③⑦①
21(12分)(1)制乙酸、催化剂、脱水剂(3分)
CH3COOH+C2H518OH![]() CH3CO18OC2H5+H2O(2分)
CH3CO18OC2H5+H2O(2分)
(2分,18O可标在乙醇中或乙酸中,但不标18O或标错,则扣3分)
(2)防止倒吸,(1分)
当液体上升到干燥管中由于球形干燥管容积大,导致试管内液面明显下降,使导管末端脱离液面,干燥管中的液体又流回试管中 (2分)
CO32-+H2O![]() HCO3-+OH- (1分) 溶液分层,上层无色油状液体,下层溶液颜色变浅 (1分)
HCO3-+OH- (1分) 溶液分层,上层无色油状液体,下层溶液颜色变浅 (1分)
(3)乙醇(1分);C(1分)【碎瓷片(或沸石)】(共2分)
(4)除去乙酸乙酯中混有的乙酸和乙醇,降低酯在水中的溶解度(2分)
五、计算题与填空(本题包括2小题,共15分)
22、(9分)
【解析】(1)6,几何构型为正八面体,1∶1,12
(2)由图(b),因为r(Cl-)>r(Na+),则r(Cl-)=![]()
2r(Na+)= a-2r(Cl-)= a-2×![]() ,即r(Na+)=
,即r(Na+)=![]()
所以,![]() =
=![]() =0.414
=0.414
(3)摩尔质量M=![]() =117
g/mol
=117
g/mol
设NaCl分子式为 (NaCl) n,则有58.5n=117 n=2,即NaCl气体的分子式为Na2Cl2。
(4) 26:27(2分)
(5)由NaCl晶体结构分析,每个晶体中含有4个“NaCl分子”,则有ρV =![]() ,所以ρ=
,所以ρ=![]() /
(5.6×10-8)3=2.2 g/cm3
/
(5.6×10-8)3=2.2 g/cm3
23.(6分)(1)解:有机物的摩尔质量为M=3.625×16g/mol=58g/mol
(2)所取得有机物的物质的量为n=1.16g÷58g/mol=0.02mol,
根据题意,设燃烧生成CO2的为xmol,则H2O的也为xmol,
有44x+18x=3.72,x=0.06
所以反应物分子式为C3H6Om,又因为有机物分子量为58,故推得有机物分子式为C3H6O
(3)根据可使溴水褪色,和金属钠反应,推得结构简式
CH2=CHCH2OH
| |