高二化学下学期第一次月考试题
高二化学
(考试时间:90分钟 满分:100分)
命题人:华安一中 林丽蓉 审题人:华安一中 黄丽坤
一、选择题(共16小题,每小题3分共48分。每小题只是一个选项符合题意)
1.下列说法中错误的是( )
A.弱电解质的电离是一个吸热过程,升温其电离度增大
B.某些盐类的水解是一个吸热过程,升温水解程度增大
C.溶液的酸碱性取决于溶液中氢离子浓度的大小
D.酸性溶液不一定是酸溶液,碱性溶液不一定是碱溶液
2.PH=2的盐酸和醋酸溶液都稀释相同的倍数后,PH的大小关系是 ( )
A.盐酸>醋酸 B.醋酸>盐酸 C.盐酸=醋酸 D.无法判断
3.相同温度下,0.1 mol/L的醋酸溶液和0.01 mol/L的醋酸溶液中氢离子浓度之比为( )
A.>10 B.<10 C.=10 D.不能确定
4.下列关于溶液酸碱性的说法错误的是( )
A.相同物质的量浓度的硫化钠溶液和硫氢化钠溶液,前者碱性较强
B.相同物质的量浓度盐酸和醋酸溶液,前者氢离子浓度较大,酸性较强
C.硝酸钠在水中能水解,溶液呈中性
D.硫酸氢钠在水中能电离出氢离子,其溶液呈酸性
5.下列条件中能促进水的电离的是( )
A.向水中加入NaOH稀溶液 B.向水中加入醋酸溶液
C.向水中加入NaCl溶液 D.向水中加入NH4Cl溶液
6.在常温下,纯水中存在电离平衡H2O![]() H++OH-,若要使水溶液的酸性增强,并使水的电离程度增大,应加入的物质是( )
H++OH-,若要使水溶液的酸性增强,并使水的电离程度增大,应加入的物质是( )
A.NaHSO4 B.KAl(SO4)2 C.NaHCO3 D.CH3COONa
7.有一支25mL酸式滴定管中盛盐酸,液面恰好在amL刻度处,把管内液体全部放出,盛入量筒内,所得液体体积一定是( )
A. a mL B.(25―a)mL
C. 大于a mL D.大于(25―a)mL
8.某学生做中和滴定实验的过程如下:a.取一支碱式滴定管;b.用蒸馏水洗净;c.加入待测NaOH溶液;d.记录液面刻度读数;e.用酸式滴定管精确放出一定量标准酸液;f.置于未经标准酸液润洗的洁净锥形瓶中;g.加入适量蒸馏水;h.加入酚酞试液2滴;i.滴定时,边滴边摇动;j.边注视滴定管内液面的变化;k.当刚滴到溶液由无色变成粉红色时,即停止滴定;l.记录液面读数;m.根据滴定管的两次得出NaOH溶液的体积为22mL。上述实验过程中的错误之处有:( )
A.f.g.k.m B.c.j.k.m C.c.h.i.k D.f.g.h.j.
9.物质的量浓度相同的下列溶液中,NH4+浓度最大的是( )
A.NH3·H2O B.NH4HSO4 C.CH3COONH4 D.NH4Cl
10.在下列各组离子中,能大量共存的是:( )
A.Ag+、NO3-、Na+、Cl- B.K+、HCO3-、Cl-、Al3+
C.NO3-、Fe2+、H+、Br- D.K+、Cl-、SO42-、NH4+
11.用物质的量都是 0.1 mol 的CH3COOH和CH3COONa 配制成 1 L混合溶液。已知其中c(CH3COO-)大于c(Na+)。对于该混合溶液下列判断正确的是( )
A.c(H+)<c(OH-) B.c(CH3COOH)+c(CH3COO-)=0.1mol/L
C.c(CH3COOH)< c(CH3COO-) D.c(CH3COO-)+c(OH-)=0.2mol/L
12. 常温下,0.1 mol/L某一元酸(HA)溶液中![]() =1×10-8,下列叙述正确的是( )
=1×10-8,下列叙述正确的是( )
A.溶液中水电离出的c(H+)=10-10 mol/L B.该一元酸(HA)是强酸
C.加水稀释,溶液的c(OH-)增大 D.溶液中c(H+)+c(A-)=0.1 mol/L
13.在Na2CO3溶液中存在如下水解平衡CO32-+H2O ![]() HCO3-+OH-
HCO3-+OH-
和HCO3-+H2O ![]() H2CO3+OH- ,往此溶液中加入下列物质,能使平衡向逆反应方向移动,且溶液的pH减小的是( )
H2CO3+OH- ,往此溶液中加入下列物质,能使平衡向逆反应方向移动,且溶液的pH减小的是( )
A.CaCl2溶液 B.盐酸 C.NaOH溶液 D.Al2(SO4)3溶液
14.在1L浓度为c mol/L的弱酸HA溶液中,HA、A- 和H+三种粒子的物质的量之和为 nc mol,则该弱酸的电离度是( )
A.100n% B.c¸n´100% C.100(n-1)% D.n%
15.如图所示装置中,a、b都是惰性电极,烧杯中为电解质溶液。通电一段时间后,a极附近呈红色。下列说法中正确的是:( )
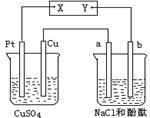
A.a是阳极,b是阴极
B.X是负极,Y是正极
C.CuSO4溶液的pH减小
D.a极产生氯气,b产生氢气
16.下图各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是 ( )
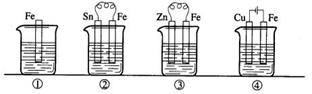 A.④>②>①>③
A.④>②>①>③
B.②>①>③>④
C.④>②>③>①
D.③>②>④>①
二、非选择题 (共52分)
17.(4分)请设计两种实验方案,探究氢氧化钠和一水合氨的碱性强弱。
18.(6分)在常温下, 200 mL含有1×10-3 mol的钡离子的氢氧化钡溶液pH值为__________。将此溶液与pH=3的盐酸混合,使其混合溶液的pH=7,应取氢氧化钡溶液和盐酸的体积之比是________。
19.(6分)在25℃时,氢氟酸、醋酸和次氯酸的电离常数分别是3.5×10-4、1.8×10-5、3.0×10-8。请推测:它们的酸性由强到弱的顺序为______________________,相同浓度的溶液中,氢离子浓度最大的是__________,电离度最小的是_______;相同浓度的氟化钠溶液、醋酸钠溶液、次氯酸钠溶液pH的从大到小顺序:_____________________________。
20.(10分)
(1)Fe2(SO4)3的水溶液呈 (填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示): ;实验室在配制Fe2(SO4)3溶液时,常将Fe2(SO4)3固体先溶于较浓的 中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解。在配制硫化钠溶液时,为了降低其水解程度,可以加入少量 。
(2)请自己设计实验探究:温度对Fe2(SO4)3水解平衡的影响。(要求写出实验步骤、现象和结论)
21.(7分)氢氧化钡是一种使用广泛的化学试剂。某课外小组通过下列实验测定某试样中Ba(OH)2·nH2O的含量。
(1)称取3.50g试样溶于蒸馏水配成100mL溶液,从中取出10.0mL溶液于锥形瓶中,加2滴指示剂,用0.100mol/LHCl标准溶液滴定至终点,共消耗标准液20.0mL(杂质不与酸反应),求试样中氢氧化钡的物质的量。
(2)另取5.25g试样加热至失去全部结晶水(杂质不分解),称得质量为3.09g,求Ba(OH)2·nH2O中的n值。
(3)试样中Ba(OH)2·nH2O的质量分数为 。
22.(10分)
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示________,K值大小与温度的关系是:温度升高,K值_______________(填“一定增大”“一定减小”或“可能增大也可能减小”)。
(2)在一体积为10L的容器中,通入一定量的CO和H2O,在800℃时发生如下反应:
CO(g)+H2O (g) ![]() CO2(g)+H2 (g) △H<0
CO2(g)+H2 (g) △H<0
CO和H2O物质的量浓度变化如下图(a)所示,则:
① 0-4min间平均反应速率v(CO)=________ mol•L-1•min-1
②在800℃时该反应的化学平衡常数K=___________________________(要求写出表达式及数值);CO的转化率=______________。
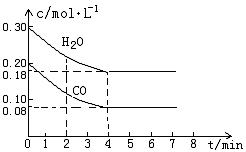
图(a)
③在800℃时,若反应开始时此容器中CO和H2O的浓度分别为0.20 mol/L和0.80 mol/L,则达到平衡时CO转化为CO2的转化率是:______________________。
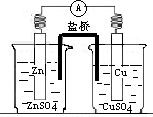 23.(9分)(1)右图为铜锌原电池的装置请回答:
23.(9分)(1)右图为铜锌原电池的装置请回答:
铜是 极,铜片上产生 ,
电极反应式为_____________________;
锌为 极,电极反应式为________________;
电池反应式为__________________________。
(2) 氢-氧燃料电池:它的负极是多孔的镍电极,正极为覆盖氧化镍的镍电极,电解质溶液是KOH溶液,在负极通入H2,正极通入O2,电极反应:负极: 正极: 电池反应式为__________________________。
高二化学试题答题卷
(考试时间:90分钟 满分:100分)
命题人:华安一中 林丽蓉 审题人:华安一中 黄丽坤
一、选择题(共16小题,每小题3分共48分。每小题只是一个选项符合题意)
二、非选择题 (共52分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | ||||
| 答案 |
17.(4分)
18.(6分)_______________;___________________________
19.(6分)_____________________________;_____________________;
______________________________________;______________________。
20.(10分)
(1)________;_________;_______________________________________;
______________;___________;________________。
(2)
21.(7分)
(1)________________;(2)_________________;(3)___________________。
22.(10分)
(1)________________________________;____________________________。
(2) ①________________;②_______________________________________;________________________;③_____________________________。
23.(9分)
(1)_____________;________________;_________________________;__________;____________________;________________________________。
(2)___________________________;_______________________________;
______________________________________________。
高二化学参考答案
一、选择题(共16题,每题3分共48分。每小题只有一个选项符合题意)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | C | A | B | C | D | B | D | B | B | D |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | ||||
| 答案 | C | C | A | C | B | A |
17.(4分)
方案1:配制物质的量浓度相同的氢氧化钠溶液和氨水, 比较溶液的导电性...
方案2:量取一定量0.1 mol/L的氢氧化钠溶液和氨水,用pH试纸测定溶液的pH...
方案3:量取一定量的某浓度的氯化钠溶液和氯化铵溶液,用pH试纸测定溶液... (其他合理答案也给分)
18.(每空3分 共6分) 12; 1∶10
19.(6分=2+1+1+2)
氢氟酸>醋酸>次氯酸;氢氟酸;次氯酸;次氯酸钠>醋酸钠>氟化钠。
20.(10分)
(1)(7分)酸 ;<
; Fe3++3H2O
![]() Fe(OH)3+3H+; 硫酸 ; 抑制 。 氢氧化钠 。
Fe(OH)3+3H+; 硫酸 ; 抑制 。 氢氧化钠 。
(2)(3分)取两支试管,各加入相同浓度的Fe2(SO4)3溶液2 mL,将其中一支试管在酒精灯火焰上加热到沸腾,观察到溶液红褐色加深;说明升高温度,促进Fe2(SO4)3水解。
21.(7分)
(1)(3分)0.01mol
(2)(2分)样品总量为(1)的1.5倍
H2O的物质的量为 ![]()
(3)(2分)![]()
22.(10分)
(1)可逆反应进行得越完全(或反应进行的程度越大);可能增大也可能减小。
(2) ① 0.03 ②![]() ;60% 。 ③ 80%
;60% 。 ③ 80%
23.(9分)
(1)正极 红色的铜 Cu2++2e-=Cu;负极 Zn-2e-=Zn2+ Zn+Cu2+= Zn2+ +Cu。
(2)H2-2e-+2OH- =2H2O 1/2O2+2e-+H2O=2OH- H2+1/2O2=H2O