高二化学化学能与电能的转化练习题(1)
一、选择题(每题有1~2个选项符合题意)
1.对于原电池的电极名称,下列叙述中错误的是( )
A.电子流入的一极为正极
B.发生还原反应的一极为正极
C.电子流出的一极为负极
D.发生氧化反应的一极为正极
2.某原电池2Fe3++Fe=3Fe2+不能实现该反应的原电池是( )
A.正极Cu负极Fe电解质溶液FeCl3
B.正极C负极Fe电解质溶液Fe(NO3)3
C.正极Pt负极Fe电解质溶液Fe2(SO4)3
 D.正极Ag负极Fe电解质溶液CuSO4
D.正极Ag负极Fe电解质溶液CuSO4
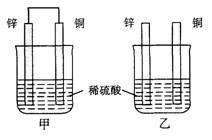
3.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速度甲比乙慢
4.X、Y、Z、W 4块金属分别用导线两两相连浸入稀硫酸中组成原电池。X、Y相连时,X为负极;Z、W相连时,电流方向是W ® Z;X、Z相连时,Z极上产生大量气泡;W、Y相连时,W极发生氧化反应。据此判断4种金属的活动顺序是( )
A. X>Z>W>Y B. Z>X>Y>W
C. X>Y>Z>W D. Y>W>Z>X
5.电子表中电子计算器的电源常用微型银锌原电池,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,放电时锌极上的电极反应是:Zn + 2OH--—2e-- == Zn(OH)2;氧化银电极上的反应式为:Ag2O + H2O + 2e-- == 2Ag + 2OH-- ,总反应式为:Ag2O + H2O + Zn== Zn(OH)2 + 2Ag。下列说法正确的是( )
A.锌是负极,氧化银是正极
B.锌发生还原反应,氧化银发生氧化反应
C.溶液中OH—向正极移动,K+ 、H+向负极移动
D.随着电极反应的不断进行,电解质溶液的pH逐渐增大
6.下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是( )
A.a电极是负极
B.b电极的电极反应为:![]()
![]()
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置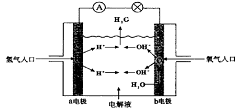
7.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为: Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s)
下列说法错误的是( )
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e—=Mn2O3(s)+2OH—(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
8.一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应为:2C2H6 +7O2+8KOH====4K2CO3+10H2O,有关此电池的推断正确的是( )
A.正极反应为14H2O+7O2+28e-====28OH-
B.放电一段时间后,负极周围的pH升高
C.每消耗1 mol C2H6 ,则电路上转移的电子为14 mol
D.放电过程中KOH的物质的量浓度不变
9.锂离子电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性。锂离子电池放电时的电极反应式为
负极反应:C6Li-x e-=C6Li1-x+xLi+(C6Li表示锂原子嵌入石墨形成复合材料)
正极反应:Li1-xMO2+xLi++x e-=LiMO2(LiMO2表示含锂的过渡金属氧化物)
下列有关说法正确的是( )
A.锂离子电池充电时电池反应为C6Li+Li1-xMO2=LiMO2+C6Li1-x
B.电池反应中,锂、锌、银、铅各失去1 mol电子,金属锂所消耗的质量最小
C.锂离子电池放电时电池内部Li+向负极移动
D.锂离子电池充电时阴极反应为C6Li1-x+xLi++x e-=C6Li
10.某可充电的锂离子电池以LiMn2O4为正极,嵌入锂的碳材料为负极,含Li+导电固体为电解质。放电时的电池反应为:Li+LiMn2O4=Li2Mn2O4。下列说法正确的是( )
A.放电时,LiMn2O4发生氧化反应
B.放电时,正极反应为:Li++LiMn2O4+e- =Li2Mn2O4
C.充电时,LiMn2O4发生氧化反应
D.充电时,阳极反应为:Li++e- =Li
二、填空题
11.铅蓄电池是最普通的二次电源,其电极材料分别是Pb和PbO2,电解质溶液为稀硫酸。工作时,该电池的总反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O根据上述情况判断
(1)蓄电池的负极是 ,其电极反应方程式为 。
(2)蓄电池的正极是 ,其电极反应方程式为_ ____。
(3)蓄电池工作时,其中电解质溶液的pH______(填“增大”、“减小”、“不变”)。
12.从铜、铁及碳棒中选取合适的电极材料设计一个原电池,实现反应:
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。
负极为 ,电极反应方程式为 ,
正极应选 ,电极反应方程式为 。
13.熔融盐燃料电池具有高的发电效率因而受到重视。可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气与CO2的混合气为阴极助燃气,制得在650℃下工作的燃料电池。完成有关的电池反应式:阳极反应式:2CO+2![]() =4CO2+4e-
=4CO2+4e-
阴极反应式:
总电池反应式:
14.一个完整的氧化还原反应方程式可以拆分,写成两个“半反应式”,一个是“氧化反应”式,一个是“还原反应”式。如2Fe3++Cu=2Fe2++Cu2+可以写成:氧化反应:Cu-2e- =Cu2+;还原反应: 2Fe3++2e- =2Fe2+。
(1) 根据以上信息将反应3NO2+H2O=2H++2![]() +NO拆分为两个“半反式”:氧化反应:
;还原反应
。
+NO拆分为两个“半反式”:氧化反应:
;还原反应
。
(2) 已知某一反应的半反应式为CH4+10OH--8e- =![]() +7H2O;4H2O+2O2+8e- =8OH-,则总反应为
。
+7H2O;4H2O+2O2+8e- =8OH-,则总反应为
。
三、计算题
15.碱性锌锰干电池中发生的总化学反应方程式为Zn + 2MnO2+ H2O = Zn(OH)2 + Mn2O3,试计算每放出1 600C的电量所需要的负极材料的质量(单位g)。
参考答案
一、选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | B | D | C | A | AD | B | C | AC | BD | B |
二、填空题
11.(1)Pb Pb-2e- + SO42- = PbSO4
(2)PbO2 PbO2 + 4H+ +SO42- = PbSO4 + 2H2O
(3)增大
12.Cu 3Cu – 6e- = 3Cu2+ 石墨 8H+ + 6e- +2NO3- = 4H2O + 2NO↑
13. O2+2CO2+4e- =2![]() 2CO+O2高温2CO2。
2CO+O2高温2CO2。
14.(1)2NO2+2H2O+2e- =2![]() +4H+ NO2+2H++2e- =NO十H2O
+4H+ NO2+2H++2e- =NO十H2O
(2)CH4+2O2+2OH-=![]() 十3H2O
十3H2O
15.n(e-)=(1600C/1.6×10-19C)/NA=1.66×10-2 mol
负极为Zn,Zn ~ 2e-
65g 2mol
m 1.66×10-2mol 求得m= 0.54g。