高二化学学业水平测试模拟试卷
化学试题 本试卷分为第I卷和第II卷两部分。试卷1至6页。共100分。考试时间75分钟。
注意事项:
1. 答卷前,考生务必将本人的学校、班级、姓名、学号、考试号填在第II卷的密封线外和机读卡上。
2. 将第I卷答案用2B铅笔填涂在机读卡上,在试卷上答题无效。第II卷直接在试卷上作答。
3. 考试结束,请将机读卡和第II卷交给监考人员。
可能用到的相对原子质量:
H-1 C-12 N-14 O-16 Na-23 S-32 Cl-35.5 Fe-56 Cu-64
第I卷(选择题,共69分)
一、本大题共17题,每题3分,共51分。在每题的四个选项中,只有一个选项是符合要求的。
1. 学习和研究化学是为了更好地认识世界,下列涉及的内容一般不属于化学研究范围的是
A.研究某种材料的用途和制备 B.研究分子的组成和结构
C.研制某种医疗药品的性质 D.探究物质的运动和规律
2.分类法是一种行之有效、简单易行的科学方法,人们在认识事物时可以采取多种分类方法。下列关于“CH3COONa”的分类不正确的是
A.化合物 B.氧化物
C.有机物 D.钠盐
3.下列关于0.15mol /L的Na2SO4溶液的说法中,正确的是
A.1L溶液中含有Na+、SO42-总数为0.3NA B.1L溶液中含有Na+数目是0.15NA
C.1 L溶液中Na+的浓度是0.3 mol / L D.2 L溶液中含有SO42—的浓度是0.3mol / L
4.下列颜色不属于因化学反应而产生的现象的是
A.无色试剂瓶中的浓硝酸呈黄色 B.久置的KI溶液呈黄色
C.新制氯水久置后变为无色 D.在普通玻璃导管口点燃纯净氢气时,火焰呈黄色
5.澳大利亚研究人员最近开发出被称为第五形态的固体碳,这种新的碳结构称作“纳米泡沫”, 他外形类似海绵,比重极小,并具有磁性。纳米泡沫碳与金刚石的关系是
A. 同一种物质 B. 同分异构体
C. 同位素 D.同素异形体
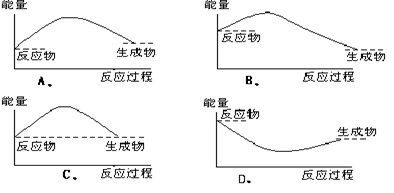 |
6.下列各图中,表示正反应是吸热反应的图是
7.下列离子方程式中正确的是
A. 在硫酸铜溶液中加入过量氢氧化钡溶液 Ba2++SO![]() =BaSO4↓
=BaSO4↓
B. 二氧化碳通入碳酸钠溶液中
CO2+CO![]() +H2O =2HCO
+H2O =2HCO![]()
C. 金属钠投入水中 Na + 2H2O = Na+ + 2OH- + H2↑
D. 氯气通入冷的氢氧化钠溶液中 2Cl2+2OH- = 3Cl-+ClO-+H2O
8.火星探测器发回的信息表明,火星上存在针铁矿[Goethite,化学式:FeO(OH)]和黄钾铁矾[Jarosite],从而证明火星表面曾经存在过水。这一发现被《人民日报》评为2004世界十大新闻之首。已知两种矿物中铁的价态相同,则黄钾铁矾{化学式记为:KFe3(SO4)2(OH)n}中n值为:
A.4 B.5 C.6 D.7
9.下列关于某些物质的检验方法或结论正确的是
A.在某未知液中加入BaCl2溶液出现白色沉淀,则溶液中肯定有SO42-
B.用焰色反应可鉴别出NaCl、KCl和Na2SO4三种物质
C.利用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液
D.在某未知液中加入NaOH溶液后再滴入酚酞试液,若显红色则原溶液中肯定有NH4+离子
10.制备单质硅时,主要化学反应如下:
①![]() ②
②![]() ③
③![]()
下列对上述三个反应的叙述中,不正确的是
A. ①③为置换反应
B. ①②③均为氧化还原反应
C. ②为化合反应
D. 三个反应的反应物中硅元素均被氧化
11.某学生设计了如下实验方案用以检验淀粉水解的情况:
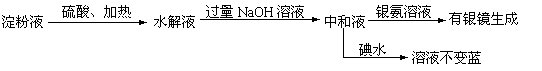 |
下列结论正确的是
A.淀粉尚有部分未水解 B.淀粉已完全水解
C.淀粉没有水解 D.淀粉已发生水解,但不知是否完全水解
12.下列各组名词或现象中,三者间没有逐级因果关系的是
A.汽车尾气的大量排放——光化学污染——咳嗽和气喘者增多
B.含磷洗衣粉的大量使用——水体富营养化——水栖生物大量死亡
C.生活污水任意排放——空气中CO2浓度增大——温室效应
D.氟氯烃的大量使用——臭氧空洞——皮肤癌患者增多
13.铵盐说法正确的是
①一般都溶于水②都是离子晶体③均受热易爆 ④大多数铵盐是常用的氮肥
⑤与强碱混合加热都有氨气放出
A. ①②③④ B. ①②④⑤
C. ①②③⑤ D. ②③④⑤
14.实验中的下列操作正确的是
A. 从试剂瓶中取出的一些Na2CO3溶液放入试管中,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中
B. 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移至容量瓶中
C. 用蒸发方法使NaCl从溶液里析出,应将蒸发皿中NaCl溶液全部蒸干才停止加热
D. 分液操作中,分液漏斗中下层液体从下口放出,上层液体也从下口倒出
15.1999年报道:爆炸性的高能N5+ 阳离子被美国加州爱德华空军基地空军研究室研究的高能材料的化学家Karl O. Christe与他的同事W.W Wilson合成。关于N5+的说法正确的是:
A.该微粒中的质子数为34 B.该微粒的电子数是34
C.该微粒由5个氮分子构成 D.它是一种由5个氮原子构成的单质分子
16.下列关于硫及含硫化合物的叙述正确的是
A.SO2的漂白原理与次氯酸相同 B.硫在空气中燃烧生成大量SO3
C.浓硫酸可以干燥H2、NH3、CO2等气体
D.常温下铝遇浓硫酸钝化,因此可用铝槽储运浓硫酸
17.下列关于有机物的说法正确的是
A.甲烷易发生加成反应 B.常温下乙烯易发生取代反应
C.乙酸乙酯是高分子化合物 D.乙醇催化氧化生成乙醛
二、本大题包括“(一)化学与生活”和“(二)有机化学基础”两个模块各6题,每题3分,每个模块18分。每位考生只需选择其中一个模块作答,若两个模块均作答,则以第一个模块计算成绩。在每题的四个选项中,只有一个选项是符合要求的。
(一)化学与生活
18.下列关于药物的使用说法正确的是
A.虽然药物能治病,但大部份药物有毒副作用
B.使用青霉素时,不用进行试验直接静脉注射
C.长期大量使用阿司匹林可预防疾病,没有副作用
D.我们生病了都可以到药店自己买药吃,不用到医院
19.下面是小王在医院做的血常规检查报告单的部分内容,小王应该注意补充的微量元素是
| No | 项目 | 结果 | 正常范围参考值 | 单位 |
| 1 | 红细胞计数 | 2.3 | 3.5~5 | 1×1012/L |
| 2 | 血红蛋白 | 75 | 110~150 | g/L |
| 3 | 血小板计数 | 205.5 | 100~300 | 109/L |
A.硒 B.锌 C.铁 D.碘
20.厨房中的化学知识很多,下面是有关厨房中的常见操作或者常见现象,其中不属于氧化还原反应的是
A.烧菜用过的铁锅,经放置常出现红棕色斑迹
B.用煤气灶燃烧沼气(主要成分为甲烷:CH4)为炒菜提供热量
C.牛奶久置变质腐败
D.用醋酸除去水垢[主要成分是CaCO3、Mg (OH)2]
21.随着化学工业的发展,各种化学合成材料已走进我们寻常百姓家,下列关于生活中常用材料的认识,正确的是
A.尼龙、羊毛和棉花都是天然纤维
B.现在生产的各种塑料在自然条件下都不可降解
C.由酚醛树脂制成的插座破裂后可以热修补
D.装食品用的聚乙烯塑料袋可以通过加热进行封口
22.下列食品添加剂与类别对应错误的是
A.调味剂——亚硝酸钠 B.防腐剂——苯甲酸钠
C.疏松剂——碳酸氢钠 D.着色剂——叶绿素
23.调查发现,某些新装修的居室中空气污染物浓度过高,对人体健康产生一定影响。这些污染物最常见的是
A.SO2 B.CO2
C.C2H4 D.苯、甲苯、醚类等有机物蒸气
(二)有机化学基础
18.制备一氯乙烷最好采用的方法是
A.乙烷与氯气反应 B.乙烯与氯气反应
C.乙烯与氯化氢反应 D.乙炔与氯化氢反应
19.将硬脂酸甘油酯和氢氧化钠溶液共热进行皂化反应,能把硬脂酸钠和甘油从混合溶液中分离出来的方法是:①盐析 ②过滤 ③蒸馏 ④分液 ⑤结晶。其中正确的组合是
A.①②③
B.①③④⑤
C.②③④ D.①②④⑤
20.下列各组物质,分别取等物质的量在足量氧气中完全燃烧,耗氧量不同的是
A. 乙烷和甲酸乙酯
B.
乙炔和乙醛
C. 乙烯和乙醇 D.乙醇和乙酸
21.下列实验能成功的是
A. 苯与浓溴水反应(Fe作催化剂)制溴苯
B. 福尔马林与苯酚的混合物,沸水浴加热制酚醛树脂
C. 氯乙烯加聚的生成物能使酸性KMnO4溶液褪色
D. 加热硫酸、乙醇、氯化钠固体的混合物制氯乙烷
22.能在有机物分子中引入羟基的反应类型有:
①酯化;②取代;③消去;④加成;⑤水解;⑥氧化。其中正确的组合是
A.①②③⑥ B.④⑤ C.②④⑤⑥ D.②④⑥
23.某有机物ng,跟足量金属钠反应生成vLH2,另取ng该有机物与足量碳酸氢钠作用生成vLCO2(同一状况),该有机物分子中含有的官能团为
A.含一个羧基和一个羟基 B.含两个羧基 C.只含一个羧基 D.含两个羟基

化学试题
| 卷别 | 第I卷 | 第Ⅱ卷 | 总分 | 积分人 | 核分人 | |||
| 题号 | 一、二(1-23) | 三(24-25) | 四 | |||||
| 26 | 27 | 28 | ||||||
| 得分 | ||||||||
注意事项:
1、 请用蓝黑水笔或钢笔直接答在试卷上。
2、 答卷前将密封线内项目填写清楚。
第I卷选择题答题卡
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 | ||||||||||||
| 题号 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | —— |
| 答案 |
第Ⅱ卷(非选择题,共31分)
三、本大题包括“(一)化学与生活”和“(二)有机化学基础”两个模块各2题,每个模块12分。每位考生只需选择其中一个模块作答,若两个模块均作答,则以第一个模块计算成绩。
(一)化学与生活
24. (6分)随着生活水平的提高,人们越来越关注自身的健康。以下是探讨化学物质与人体健康的有关问题:
(1)发育出现障碍,患营养缺乏症,这主要是由于摄取_________(填“蛋白质”、“脂肪”或“维生素”)不足引起的。
(2)微量元素与人体健康密切相关,若膳食结构不合理,摄入某种微量元素不足,就会引起某些疾病,例如身材矮小,腰背弯曲可能是由于缺________,_________元素是合成甲状腺激素的重要原料;人体铁元素摄入量不足可能会导致_________。
(3)人体摄入过多的食物时,会引起胃酸分泌过多,胃酸的pH下降,使人体感到不适,此时应服用消酸剂,双羟基铝酸钠就是一种常用的消酸剂,其化学式为NaAl(OH)2CO3,由于Al3+在人体内难以代谢,含量过高可导致老年痴呆症等疾病,为防止人体摄入过量铝元素,请提一条合理的建议____________________________________ _______________。
25.(6分)(1)小明在整理房间时,清理出如下物品:A.废作业本B.生锈铁钉C.坏日光灯管 D.电池属于可回收垃圾的是 (填序号)。
(2)铁器件不仅容易受到环境中化学物质的侵蚀而发生化学腐蚀,在潮湿的空气中还能发生 腐蚀。
请你根据钢铁锈蚀不同原理,提出防止钢铁锈蚀的两条合理措施。
。
(二)有机化学基础
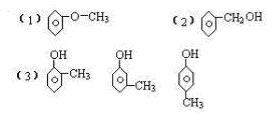
24. (6分)某芳香族化合物的分子式为C7H8O,根据下列实验现象确定其结构简式:
(1)不能与金属钠反应,其结构简式的_____________ ______________。
(2)能与钠反应,但遇FeCl3不显色______________ __ __ __________。
(3)能与钠反应且遇FeCl3显紫色__________________ ____________。
25.(6分)有机物A是烃的含氧衍生物。在同温同压下,A蒸气的质量是同体积乙醇的2倍。1.38g的A完全燃烧后,将燃烧产物先通过H2SO4,再通过碱石灰,浓H2SO4质量增重1.08g,碱石灰增重1.98g,取4.6gA与足量钠反应,生成气体在标准状况下的体积为1.68L。已知A不与纯碱反应,试确定A的结构简式和名称。
四、本大题共3题,共19分。
26.(6分)元素在周期表中的位置,反映了元素的原子结构和元素的性质。右图是元素周期表的一部分。
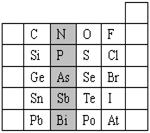 (1)阴影部分元素N在元素周期表中的位置为 。
(1)阴影部分元素N在元素周期表中的位置为 。
根据元素周期律,请你预测:H3AsO4、H3PO4 的酸性强弱:
H3AsO4 H3PO4。(用“>”、“<”或“=”表示)
(2)元素S的最高正价和最低负价分别为 、 ,在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断在相同条件下Se与H2反应的限度(选填“更大”、“更小”或“相同”) 。
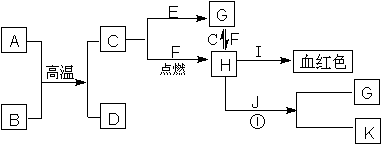
27.(4分)已知:A、C、J为日常生活中常见的金属单质,其中A、C均呈银白色,J呈紫红色。A是地壳中含量最高的金属元素,B是一种红棕色金属氧化物。它们之间的转化关系如下图。反应①在工业上可用于制作电路板。请回答下列问题:
(1)写出C和I的化学式: 、 。
(2)写出反应①的离子方程式: 。
28.(9分)将200mL稀硝酸与足量的铜粉在微热的条件下发生反应,经测定,生成了1.12LNO(标准状况)。试计算
(1)参加反应的铜的质量;
(2)该硝酸溶液中HNO3的物质的的量浓度;
(3)现用12.5mol/L的浓硝酸来配制500mL该稀硝酸。可供选择的仪器有:①玻璃棒②烧瓶③烧杯④胶体滴管⑤量筒⑥托盘天平⑦药匙。上述仪器中,配制时不需要使用的仪器有___________________(填代号),还缺少的一种仪器是________________。
化学试题参考答案及评分标准
第一卷
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | D | B | C | D | D | A | B | C | C |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | |
| 答案 | D | B | C | B | B | B | D | D |
《化学与生活》
| 题号 | 18 | 19 | 20 | 21 | 22 | 23 |
| 答案 | A | C | D | D | A | D |
《有机化学基础》
| 题号 | 18 | 19 | 20 | 21 | 22 | 23 |
| 答案 | C | A | D | D | C | A |
第二卷
《化学与生活》
24.(1)蛋白质 (2)碘、碘、缺铁性贫血(3)使用碳酸氢钠作为消酸剂
25.(1) A B (2) 电化学 烤蓝 涂油漆
《有机化学基础》
24.
25. 则A的结构简式为:
![]()
名称为:丙三醇
三.
26.(1)第二周期 VA (2分) < (1分) (2)+6 (1分) -2 (1分) 更小(1分)
27.(1) Fe (1分)、 KSCN (1分) (2)2Fe3++Cu=Cu2++2Fe2+ (2分)
28.(1)4.8g (2分) (2)1 mol/L (3分) (3) ②⑥⑦ (2分) 500mL容量瓶(2分)