高二化学上册模拟试题二 姓名
第Ⅰ卷(选择题 共 48 分)
一、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意)
1.具有下列电子排布式的原子中,半径最大的是
A.ls22s22p63s23p3 B.1s22s22p3
C.1s22s2sp4 D.1s22s22p63s23p4
2.对于H3O+的下列说法中正确的是
A.O原子采用SP2杂化 B.O原子采用SP3杂化
C.离子中存在离子键 D.离子中存在非极性键
3.下列关于原子结构的叙述正确的是
A.在多电子的基态原子中,不可能有运动状态完全相同的两个电子存在
B.在多电子的基态原子中,能量最高的电子都是距离原子核最近的电子
C.在多电子的基态原子中,所有S电子的原子轨道都是球形的,半径也完全相同
D.对于多电子原子,其核外电子完全按能层次序排布,填满一个能层才开始填下一能层
4.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是
A. 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B. 沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+
C. 在[Cu(NH3)4]2+离子中,配位原子是Cu2+
D. 在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道
5.下列离子方程式正确的是
A.氯气通入冷水中 Cl2+H2O = Cl—+ClO—+2H+
B.碳酸镁悬浊液中加醋酸 CO32—+2CH3COOH = 2CH3COO—+CO2↑+H2O
C.明矾溶液与小苏打溶液混合 Al3++3HCO3-=Al(OH)3↓+3CO2↑
D.NaHS水解 HS-+H2O![]() H3O++S2-
H3O++S2-
6.某反应:A == B + C 在室温下不能自发进行,在高温下能自发进行,对该反应过程中△H、△S的判断正确的是
A.△H>0、△S>0 B.△H>0、△S<0
C.△H<0、△S>0 D.△H<0、△S<0
7.下列现象与氢键有关的是:
①NH3的熔、沸点比VA族其他元素氢化物的高
②小分子的醇、羧酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④尿素的熔、沸点比醋酸的高
⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
⑥水分子高温下也很稳定
A.①②③④⑤⑥ B.①②③④⑤ C.①②③④ D.①②③
8.下列说法中正确的是
A.原子间通过共价键而形成的三维网状结构的晶体一定具有高的熔、沸点及硬度
B.P4和CH4都是正四面体形分子且键角都为109o28ˊ
C.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道
D.NO2、SO2、BF3、NCl3分子中原子最外层电子都满足了8e-稳定结构
二、选择题(本题包括6小题,每小题4分,共24分。每小题有1-2个选项符合题意)
9.常温下,浓度为0.1 mol/L的一元酸HA溶液的pH=2.0,浓度为0.1 mol/L的一元碱BOH溶液中![]() =1.0×10-12。将此两种溶液等体积混合后,所得溶液中离子浓度大小关系正确的是
( )
=1.0×10-12。将此两种溶液等体积混合后,所得溶液中离子浓度大小关系正确的是
( )
A.c(OH-)>c(H+)>c(B+)>c(A-) B.c(B+)>c(A-)>c(H+)>c(OH-)
C.c(B+)>c(A-)>c(OH-)>c(H+) D.c(B+)>c(A-)>c(H+)>c(OH-)
10.在一密闭容器中,反应m A(g)+n B(g) ![]() 3 C(g)达到平衡时,测得c(A)=0.5 mol/L。在温度不变的情况下,将容积增大一倍,当达到新的平衡时,测得c(A)=0.30mol/L。下列判断中正确的是
( )
3 C(g)达到平衡时,测得c(A)=0.5 mol/L。在温度不变的情况下,将容积增大一倍,当达到新的平衡时,测得c(A)=0.30mol/L。下列判断中正确的是
( )
A.A的质量分数减小 B.平衡向右移动
C.化学计量数:m+n > 3 D.物质C的体积分数减小
11.室温下,用pH相同且体积也相同的醋酸和盐酸的稀溶液分别进行下列实验,有关叙述正确的是
A.两溶液均加水稀释2倍后,盐酸的pH增大,醋酸的pH减小
B.使温度都升高20℃后,两溶液的pH均不变
C.加适量的醋酸钠晶体溶解后,两溶液的pH均增大
D.加足量的锌充分反应后,醋酸产生的氢气比盐酸多
12.灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①Sn(s, 白)+2HCl(aq)===SnCl2(aq)+H2↑(g) ΔH1
②Sn(s, 灰)+2HCl(aq)===SnCl2(aq)+H2↑(g) ΔH2
![]()
③Sn(s, 灰) Sn(s, 白) ΔH3=2.1kJ·mol-1
下列说法正确的是
A.ΔH1>ΔH2
B.锡在常温下以灰锡状态存在
C.灰锡转化为白锡的反应是放热反应
D.白锡制的器皿长期处在低于13.2℃的环境中,会自行毁坏
![]() 13.一定温度下,在恒容密闭容器中发生如下反应:2A(g) + B(g)
3C(g),若反应开始
13.一定温度下,在恒容密闭容器中发生如下反应:2A(g) + B(g)
3C(g),若反应开始
时充入2 mol A和2 mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数小于a%的是
A.1 mol B和3 mol C B.1 mol B和2 mol C
C.2 mol A、1 mol B和1 mol He(不参加反应) D.2 mol A、4 mol B和3 mol C
14. 已知0.1mol·L-1的二元酸H2A溶液的pH=4,则下列说法中正确的是
A.在Na2A、NaHA两溶液中,离子种类相同
B.在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等
C.在NaHA溶液中一定有c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-)
D.在Na2A溶液中一定有c(Na+)>c(A2-)>c(H+)>c(OH-)
第Ⅱ卷(非选择题 共72分)
15.下列实验操作或对实验事实的叙述正确的是 (填序号)。
①用碱式滴定管量取20.00mL 0.10mol·L-1KMnO4溶液
②用托盘天平称取12.58g干燥的NaOH固体时,各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘纸上称量
③将干燥的pH试纸浸到某溶液中,过一会取出与标准比色卡比较,测得该溶液的pH
④中和滴定中,锥形瓶用蒸馏水洗净后直接往其中注入一定量的待测溶液
⑤把铁钉和碳棒用导线相连浸入食盐水中,碳棒上放出氯气
⑥用吸收了CO2的固体NaOH配制的标准溶液去测定未知浓度的盐酸,测定结果偏低
⑦配制氯化亚锡溶液时,需加少量盐酸
⑧铁件上镀银时,应将银电极与直流电源的正极相连,用AgNO3溶液作电镀液
16.据文献报导,有人提出由焦炭与水和氧气在一定条件下制取重要的有机化工原料醋酸:
![]() 2C(s)+2H2(g)+O2(g) CH3COOH(l)
2C(s)+2H2(g)+O2(g) CH3COOH(l)
已知:(1)CH3COOH(l) + 2O2(g) = 2CO2(g)+ 2H2O(l) △H1 = -870.3KJ/mol
(2)C(s) + O2(g) = CO2(g) △H2 = -393.5 KJ/mol
(3)H2(g) + 1/2O2(g) = H2O(l) △H3 = -285.8KJ/mol
试回答:
(1)1molH2(g)所具有的能量比1mol H2O(l)所具有的能量 (填高、低、无法比较)。
![]() (2)反应2C(s)+2H2(g)+O2(g) CH3COOH(l)的焓变为
。
(2)反应2C(s)+2H2(g)+O2(g) CH3COOH(l)的焓变为
。
(3)在下列选项中选择用此法制取醋酸的最适宜条件 。
A.常温 B.适当高温 C.合适催化剂 D.常压 E.适当高压
(4)用此法制取1000mol醋酸时所放出的热量最多能将 千克25℃的水升温到75℃。(假设热量不散失,水的比热容为4.2kJ/(kg·℃)
17.在一固定容积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH=QkJ·mol-1,
CO(g)+H2O(g) ΔH=QkJ·mol-1,
其化学平衡常数K和温度t的关系如下:
| t/℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.25 |
请回答:
(1)上述反应中Q 0(选填“>”或“<”);
(2)能判断该反应已达到化学平衡状态的依据是 ;
a.容器中压强不变 b.ΔH不变
c.v正(H2)=v逆(CO) d. CO2的质量分数不变
(3)温度为850℃时,可逆反应CO(g)+H2O(g)![]() CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内各物质的浓度变化如下表:
CO2(g)+H2(g)在固定容积的密闭容器中进行,容器内各物质的浓度变化如下表:
850℃时各物质的物质的量浓度(mol·L-1)的变化
| 时间/min | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
①计算:3min时c(CO))= mol·L-1 , H2O(g)的转化率= ;
②反应在4min~5min之间,平衡向逆方向移动,可能的原因是 (单选),
表中5min~6min之间数值发生变化,可能的原因是 (单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气
18.下图是元素周期表的一部分
| ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ||||||||||||||
| ⑥ | ⑦ | ⑧ | |||||||||||||||
| ⑨ | ⑩ |
(1)写出元素⑩的基态原子的电子排布式_______________,指出它在周期表中的位置_______________。焊接钢轨时,常利用⑩的某些氧化物与⑦的单质在高温下发生反应,试写出其中一种反应的化学方程式__ ____ 。
(2)①③⑤三种元素可以形成多种有机化合物分子,其中一种是室内装潢时形成的主要气体污染物。试写出它的电子式_________________,根据价层电子对互斥(VSEPR)理论推测该分子的空间构型为__ ___。
(3)③④⑤⑥⑧五种元素都可以与元素①形成化合物,其中熔点最高的是_________(写化合物的化学式)。如果在温度接近373K时,根据M=m/n测定⑤的气态氢化物的相对分子质量,结果发现测定结果比理论值高,其原因是 。
(4)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式: 。
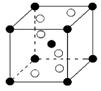 (5)元素⑨的主要矿物有钛铁矿(主要成分FeTiO3)和金红石,金红石
(5)元素⑨的主要矿物有钛铁矿(主要成分FeTiO3)和金红石,金红石
的主要成分的晶胞结构如右图所示:(以钛为中心原子,6个氧在其
周围形成八面体结构,斜放在晶胞中)金红石的主要成分钛的氧
化物化学式可表示为 。
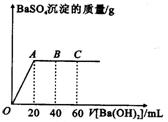 19.在25℃时向20mL稀硫酸和盐酸的混合溶液中,逐滴加入pH=13的Ba(OH)2溶液,生成BaSO4的质量如图所示,当加入60mLBa(OH)2溶液时,C点溶液的pH=7,试回答:
19.在25℃时向20mL稀硫酸和盐酸的混合溶液中,逐滴加入pH=13的Ba(OH)2溶液,生成BaSO4的质量如图所示,当加入60mLBa(OH)2溶液时,C点溶液的pH=7,试回答:
(1)最初混和溶液中硫酸和盐酸的物质的量浓度是多少?
(2)计算B点溶液中H+的物质的量浓度。
(3)在C点时,向反应后溶液中继续滴加足量的Na2CO3溶液,
最终生成的沉淀总物质的量是多少?
高二化学模拟试题二参考答案
1.A 2.B 3.A 4.B 5.C 6.A 7.B 8.A
9.C 10.CD 11.CD 12.D 13.BD 14.AC
15.④⑦⑧
16.(1)无法比较 (2)-488.3KJ/mol (3)BCE (4)2325kg
17.(1)> (2)c、d
(3)①0.08 40%
②d a
18.(1)ls22s22p63s23p63d64s2 第四周期Ⅷ族 铝热剂反应式
(2) 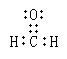 平面三角形
平面三角形
(3)NaH(1分)接近沸点的水蒸气中存在相当量的通过氢键而形成的缔合分子
(4)Be(OH)2+2NaOH=Na2BeO2+2H2O
(5)TiO2
19.(1)C(H2SO4)=0.05mol/L C(HCl)=0.2mol/L
(2)C(H+)=1/30mol/L=0.033mol/L
(3)n(沉淀)=n(Ba2+)=0.003mol