高二化学上册第三次质量检测题
化 学 试 题
第I卷(选择题,共54分)
一、选择题(本题包括18小题,每小题3分,共54分。每小题只有一个选项符合题意)
1.氢能是一种既高效又干净的新能源,发展前景良好,用氢作能源的燃料电池汽车倍受青睐。我国拥有完全自主知识产权的氢燃料电池轿车“超越三号”,已达到世界先进水平,并加快向产业化的目标迈进。氢能具有优点包括 ( )
①原料来源广 ②易燃烧、热值高 ③储存方便 ④制备工艺廉价易行
A.①② B.①③ C.③④ D.②④
2.下列过程或现象与盐类水解无关的是
A.纯碱溶液去油污 B.铁在潮湿的环境下生锈
C.加热氯化铁溶液颜色变深 D.浓硫化钠溶液有臭味
3.下列属于强电解质的是 ( )
①NaOH ②NH3·H2O ③CaCO3 ④CH3COOH ⑤NaHCO3
A.①②③ B.②③④ C.①③⑤ D.①④⑤
4.用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率增大的是 ( )
A.对该反应体系加热 B.改用98%浓硫酸
C.滴加少量硫酸铜溶液 D.不用铁片,改用铁粉
5.下列说法中,不正确的是 ( )
A.焓变为正值的反应都是吸热反应
B.放热的,熵增加的反应一定能自发进行
C.同一条件下,氨水在不同物质的量浓度的溶液中,其电离程度是不同的
D.强电解质都是离子化合物,弱电解质都是共价化合物
6.对于处于化学平衡状态的反应CO(g)+H2O(g)![]() CO2(g)+H2(g) △H<0,若要提高CO的转化率,下列措施中可行的是 ( )
CO2(g)+H2(g) △H<0,若要提高CO的转化率,下列措施中可行的是 ( )
A.升温B.增大H2O(g)的浓度 C.增大压强 D.使用合适催化剂
7.一定温度下,向BaSO4悬浊液中加水,下列叙述正确的是 ( )
A.BaSO4的溶解度、Ksp均不变 B.BaSO4的溶解度增大、Ksp不变
C.只有BaSO4的Ksp增大 D.BaSO4溶解度、Ksp均增大
8.可以判定某酸HA是弱电解质的事实是 ( )
A.其盐溶液呈酸性 B.该酸可溶解Cu(OH)2
C.该酸可以 CaCO3反应放出CO2 D.室温时0.01mol·L-1HA溶液pH = 4
9.下列措施一定能使反应速率加快的是 ( )
①增加反应物的物质的量 ②升高温度 ③缩小反应容器体积 ④加入生成物
⑤加入MnO2
A.全部 B.①②⑤ C.② D.②③
|
A.Fe-2e-= Fe2+ B.2H2O+O2+4e-= 4OH-
C.2H++2e-= H2↑ D.4OH--4e-=2H2O+O2↑
11.下列说法中正确的是 ( )
A.在相同条件下,若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由“C(石墨) = C(金刚石);△H = +1.9kJ·mol-1”可知,金刚石比石墨稳定
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ·mol-1,若将含0.5mol H2SO4的浓硫酸与1mol NaOH溶液混合,放出的热量大于57.3 kJ
D.在101Kpa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l);△H= +285.8kJ·mol-1
12.下列说法不正确的是 ( )
A.pH=3的醋酸与pH=11的NaOH溶液等体积混合后,溶液的pH一定小于7
B.pH<7的溶液一定是酸溶液
C.pH=5的溶液和pH=3的溶液相比,前者c(OH-)是后者的100倍
D.在1mol·L-1的氨水中,改变外界条件使c(NH4+)增大,溶液的pH不一定增大
13.下列反应的离子方程式书写正确的是 ( )
A.在碘化亚铁溶液中通入足量Cl2 2Fe2++2I-+2Cl2 2Fe3++I2+4Cl-
B.在AlCl3溶液中加入Na[Al(OH)4]溶液 Al3++[Al(OH)4]-+3H2O 2Al(OH)3↓
C.氯化铵在水溶液中水解 NH![]() +H2O
+H2O NH3·H2O+H+
D.硫酸铁溶液中加入过量氨水 Fe3++3NH3·H2O Fe(OH)3↓+3NH![]()
14.下列操作中,能使水的电离平衡向右移动,而且使所得溶液显酸性的是 ( )
A.在水中加入少量氯化钠,并加热到100℃
B.在水中滴人稀硫酸
C.在水中加入小苏打
D.在水中加入氯化铝固体
15.某溶液中加入铝片有氢气产生,则在该溶液中一定能够大量共存的离子组是 ( )
A.. S2-、NO3-、Ba2+、Na+ B.Na+、K+、SO42-、Cl-
C.NH4+、Ba2+、Cl-、HCO3- D.SO42-、CH3COO-、Al3+、Mg2+
16.在物质的量浓度均为0.01 mol·L-1的CH3COOH和CH3COONa的混合液中,测得
c(CH3COO-)>c(Na+),则下列关系正确的是 ( )
A.c(H+)=c(OH-) B.c(H+)<c(OH-)
C.c(CH3COOH)>c(CH3COO-)
D.c(CH3COOH)+c(CH3COO-)=0.02mol·L-1
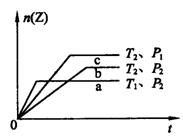
![]() 17.反应2X(g)+Y(g) 2Z(g)(正反应为放热反应),在不同温度(T1和T2)及不同压强(P1和P2)下,产物Z的物质的量n(Z)与反应时间(t)的关系如右图中a、b、c三曲线所示。下述判断中正确的是 ( )
17.反应2X(g)+Y(g) 2Z(g)(正反应为放热反应),在不同温度(T1和T2)及不同压强(P1和P2)下,产物Z的物质的量n(Z)与反应时间(t)的关系如右图中a、b、c三曲线所示。下述判断中正确的是 ( )
|
C.T1>T2;P1>P2 D.T1<T2;P1<P2
|
电池的作用,将化学能转变为电能;而充电时起电解池的作
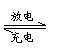 用,将电能转变为化学能贮存起来。某蓄电池充电和放电时
用,将电能转变为化学能贮存起来。某蓄电池充电和放电时
发生的反应为:Fe+NiO2+2H2O Fe(OH)2+Ni(OH)2。关于此蓄电池有下列说法:
①放电时,NiO2为正极;②充电时,阳极反应式为:Fe(OH)2+2e-= Fe+2OH-;
③放电时,电解质溶液中的阳离子向正极方向移动;
④充电时,Ni(OH)2的反应式为:Ni(OH)2-2e-= NiO2+2H+;
⑤蓄电池的电极必须浸在碱性电解质溶液中;
其中正确的组合是 ( )
A.②③④ B.①②③ C.②④⑤ D.①③⑤
|
.![]() 19.(8分)在某温度下,A+B 2C类型的反应达到平衡:
19.(8分)在某温度下,A+B 2C类型的反应达到平衡:
(1)若升高温度时,C的浓度减小,则正反应是 热反应,在升高温度时,正反应速率 (填“增大”、“减小”或“不变”,下同),逆反应速率 。
(2)在增加或减少B物质时,平衡不移动,则B物质为 态。
(3)若A为气态物质,增大压强平衡不移动,则B的物质为 态,C为 态。
(4)若加入正催化剂,平衡 移动,达到平衡状态的时间 (填“延长”、“缩短”或“不变”)。
|
A.取20.00 mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴
酚酞试液
B.用标准氢氧化钠溶液润洗滴定管2~3次
C.把盛有标准氢氧化钠溶液的碱式滴定管固定好,调节滴定管尖嘴使
之充满溶液
D.取标准氢氧化钠溶液注入碱式滴定管至“0”刻度以上2~3mL处
E.调节液面至“0”或“0”刻度以下,记下读数
| |
回答下列问题:
(1)正确的操作顺序是:B、 、F(填序号)
(2)上述B步骤操作的目的是 ;
(3)上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则对滴定结果的影响是
(填“偏大”或“偏小”或“无影响”);
(4)判断到达滴定终点的实验现象是 ;
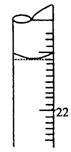
(5)若滴定结束时,滴定管液面如图所示,则终点读数为 mL。
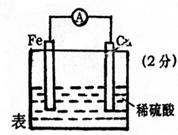
21.(10分)某校化学研究性学习小组设计实验验证Fe、Cu的金属活动性,他们提出了以下两种方案。请你帮助他们完成有关实验项目:
方案Ⅰ:有人提出将大小相等的铁片和铜片,分别同时放入稀H2SO4(或稀盐酸)中,观察产生气泡的快慢,据此确定它们的活动性。该原理的离子方程式为
。
方案Ⅱ:有人利用Fe、Cu作电极设计成原电池,以确定它们的活动性。试在下面的方框内画出原电池装置图,标出原电池的电极材料和电解质溶液,并写出电极反应式。
| |
;
负极反应式:
。
结合你所学的知识,帮助他们再设计一个验证Fe、Cu活动性的简单实验方案(与方案Ⅰ、Ⅱ不能雷同): ,
用离子方程式表示其反应原理: 。五、(本题包括2小题,共20分)
22.(8分)在一恒容密闭容器中发生某化学反应
|
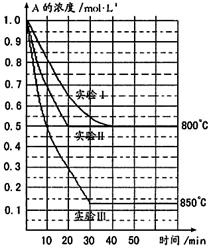
其中实验Ⅰ、Ⅱ在800℃,实验Ⅲ
在850℃,B、C的起始浓度都为0,反应
物A的浓度(mol·L—1)随时间(min)
变化如右图所示,请回答:
|
2A(g)![]() B(g)+C(g)的正反应为
B(g)+C(g)的正反应为
(选填“放热”或“吸热”)
反应。
(2)在实验Ⅰ中,反应在20min至30min
内A的平均反应速率为 。
(3)实验Ⅱ与实验Ⅰ比较,可能隐含的反应条
件是 。
(4)与实验Ⅰ比较,若将实验Ⅰ中A的起始浓度改为1.5mol·L—1,其他条件不变,则达到平衡时,所用时间 实验Ⅰ(选填“<”“=”“>”“无法确定”)
|
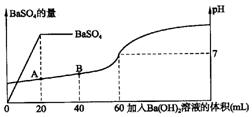
问:(1)最初的混合溶液中H2SO4和HCl的物质的量浓度各为多少?
(2)在上图中,A点所示溶液的pH是多少?(注:lg2=0.301,lg5=0.699,答案保留两位有效数字,溶液密度变化及析出沉淀对溶液体积的影响忽略不计)
 . 化 学 答 题 卷
. 化 学 答 题 卷
一:选择题
| 题 号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 选 项 | . | |||||||||
| 题 号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| 选 项 |
. 19.(8分).
(1). ., , 。
(2). .。
(3). ., .。
(4).. .,. .。
20(1).B、 F.
(2). ;
(3).
(4). ;
(5). .。
21..
方案Ⅰ:. .
方案Ⅱ:.。
| |
. 。
. ,
. 。
|
.(2). 。
(3). 。
(4). .
23.(10分).
(1)
.
.
.
(2).
参考答案
1.A 2. B 3.C 4.B 5.D 6.B 7.A 8.D 9.C 10.C(每个小题2分,共20分)
11.C 12.D 13.D 14.D 15.B 16.B 17.C 18.D (每个小题3分,共20分)
19.(1)放 增大 增大 (2)固 (3)气 气 (4)不 缩短
.
|
(1)D C E A (2分)
(2)防止滴定管内壁附着的水将标准溶液稀释而带来误差(2分)
(3)偏大(2分)
(4)溶液由无色变为浅红色,且半分钟内不褪色(2分)
(5)21.10 (2分)
.
|
Ⅱ:正极:2H+ + 2e- → H2↑(1分)
负极:Fe →Fe2+ + 2e分-(1分)
Ⅲ:将铁片置于CuSO4溶液中,一段时间后
观察Fe表面是否有金属铜析出(2分)
Fe + Cu2+ = Cu + Fe2+(1分)
..
22.(8分)
(1)吸热(2分)(2)0.1mol·L-1·min-1(2分,单位写错不得分)
(3)催化剂(2分) (4)<(2分)
23.(12分)
(1)因为20mL 0.025 mol·L-1Ba(OH)2溶液恰好与20mL混合溶液中的硫酸反应。
c(H2SO4)=(0.02L×0.025mol·L-1)/0.025mol·L-1=0.025mol·L-1(2分)
因为当滴入60mLBa(OH)2溶液时所得溶液为中性。
c(HCl)=(0.04L×0.025mol·L-1×2)/0.02L=0.1mol·L-1(2分)
硫酸的物质的量浓度为0.025mol·L-1,盐酸的物质的量浓度为0.1mol·L-1
(2)在A点,c(H+)=(0.04L×0.025mol·L-1×2)/0.04L=0.05mol·L-1(2分)
pH=-lgc(H+)=-lg0.05=-lg(5×10-2)=2-lg5=2-0.699=1.3(1分)