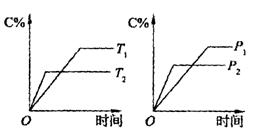
高二化学上册第二次质量检测题
化 学 试 题 命题:臧峰
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 S 32
Cl 35.5 K 39 Zn 65
第I卷(选择题,共54分)
一、选择题(本题包括18小题,每小题3分,共48分。每小题只有一个选项符合题意)
1.下列说法中正确的是
A.凡是放热反应都是自发的,由于吸热反应都是非自发的
B.自发反应在适当条件下才能实现
C.自发反应在任何条件下都能实现
D.自发反应一定是熵增大,非自发反应一定是熵减小或不变
2.对于某一化学反应,下列各项反应条件改变,能使反应历程改变,降低化学反应的活化能,从而提高反应速率的是
A.增大反应物浓度 B.加压
C.加催化剂 D.升温
3.对于任何一个平衡体系,采用以下措施,一定会使平衡移动的是
A.加入一种反应物 B.升高温度
C.对平衡体系增加压强 D.使用催化剂
4.下列关于铜电极的叙述,正确的是
A.铜锌原电池中铜是负极
B.用电解法精炼粗铜时,精铜作阳极
C.在镀件上电镀铜时可用金属铜作阳极
D.电解稀硫酸制H2、O2时,铜作阳极
5.在一定温度下的恒容密闭容器中,进行如下反应:2SO2(g)+O2(g)![]() 2SO3(g),已知反应过程中,某时刻SO2、SO3、O2浓度分别是0.2mol·L-1、0.2mol·L-1、0.1mol·L-1,根据极端值的思维方法,当反应达到平衡时,下列数据中,有可能存在的是
2SO3(g),已知反应过程中,某时刻SO2、SO3、O2浓度分别是0.2mol·L-1、0.2mol·L-1、0.1mol·L-1,根据极端值的思维方法,当反应达到平衡时,下列数据中,有可能存在的是
A.c(SO2)=0.4mol·L-1 B.c(SO2)=0.25mol·L-1
C.c(SO2)=c(SO3)=0.15mol·L-1 D.c(SO3)=0.4mol·L-1
6.在某温度下,可逆反应mA + nB![]() pC + qD的平衡常数为K,下列说法正确的是
pC + qD的平衡常数为K,下列说法正确的是
A.K越大,达到平衡时,反应进行的程度越大
B.K越小,达到平衡时,反应物的转化率越大
C.K随反应物浓度的改变而改变
D.K随温度和压强的改变而改变
7.α1和α2分别为A、B在两个恒容容器中平衡体系A(g)![]() 2B(g)和2A(g)
2B(g)和2A(g)![]() B(g)的转化率,在温度不变的情况下,均增加A的物质的量,下列判断正确的是
B(g)的转化率,在温度不变的情况下,均增加A的物质的量,下列判断正确的是
A.α1、α2均减小 B.α1、α2均增大
C.α1减小,α2增大 D.α1增大,α2减小
8.据环保部门测定,我国一些大城市的酸雨pH=3.5。在酸雨季节铁制品极易腐蚀,则在其腐蚀中正极发生的反应是
A.Fe-2e-=Fe2+ B.2H2O+O2+4e-=4OH-
C.2H++2e-=H2↑ D.4OH--4e-=2H2O+O2↑
 9.分析右面的能量变化示意图,确定下列选项中正确的是 A.2
A(g)+
B(g) = 2 C(g);
△H<0
9.分析右面的能量变化示意图,确定下列选项中正确的是 A.2
A(g)+
B(g) = 2 C(g);
△H<0
B.2 A(g)+ B(g) = 2 C(g); △H>0
C.2 A + B = 2 C;△H<0
D.2 C = 2 A +B ;△H<0
![]() 10.增大压强,对已达到平衡的下列反应3X(g)+Y(g) 2Z(g)+2Q(s)产生的影响是
10.增大压强,对已达到平衡的下列反应3X(g)+Y(g) 2Z(g)+2Q(s)产生的影响是
A.正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B.正反应速率减小,逆反应速率增大,平衡向逆反应方向移动
C.正、逆反应速率都增大,平衡向正反应方向移动
D.正、逆反应速率都没有变化,平衡不发生移动
11.反应C(s)+H2O(g)![]() CO(g)+
H2(g) 在一可变容积的密闭容器中进行,在其它条件不变的情况下,下列条件的改变对其反应速率几乎无影响的是
CO(g)+
H2(g) 在一可变容积的密闭容器中进行,在其它条件不变的情况下,下列条件的改变对其反应速率几乎无影响的是
A.增加CO的物质的量
B.将容器的体积缩小一半
C.保持体积不变,充入N2使体系压强增大
D.保持压强不变,充入N2使容器体积变大
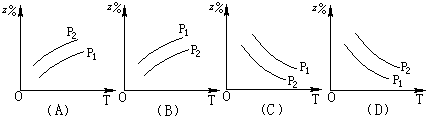
![]() 12.如图所示,反应:X(气)+3Y(气) 2Z(气) △H<0,在不同温度、不同压强(p1>p2)下,达到平衡时,混合气体中Z的百分含量随温度变化的曲线应为
12.如图所示,反应:X(气)+3Y(气) 2Z(气) △H<0,在不同温度、不同压强(p1>p2)下,达到平衡时,混合气体中Z的百分含量随温度变化的曲线应为
13.将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应:
![]() 2A(气)+B(气) 2C(气),若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法:
2A(气)+B(气) 2C(气),若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法:
① 用物质 A 表示的反应的平均速率为 0.3 mol·L-1·s-1
② 用物质 B 表示的反应的平均速率为 0.6 mol·L-1·s-1
③ 2 s 时物质 A的转化率为70%
④ 2 s 时物质 B的浓度为 0.7 mol·L-1
其中正确的是
A.①③ B.①④ C.②③ D.③④
14.在1L K2SO4和CuSO4的混合溶液中c(SO42-) = 2.0 mol•L-1,用石墨电极电解此溶液,当通电一段时间后,两极均收集到22.4L(标准状况)气体,则原溶液中c(K+)为
A.2.0 mol•L-1 B.1.5 mol•L-1 C.1.0 mol•L-1 D.0.50 mol•L-1
|
系如图所示:
根据图中曲线分析,判断下列叙述
中,正确的是
A.到达平衡后,若使用催化剂,C的
质量分数增大
B.平衡后,若升高温度,平衡则向逆反
应方向移动
C.平衡后增大A的量,有利于提高A的转化率
D.化学方程式中![]()
16.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:
Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s)
下列说法错误的是
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e—=Mn2O3(s)+2OH—(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
![]() 17.一定量的混合气体,在密闭容器中发生如下反应:
xA(气)+yB(气) zC(气)达到平衡后,测得A的浓度为0.5 mol·L-1;在恒温下将密闭容器的体积扩大为平衡时的两倍,再达到平衡时,测得A的浓度为0.3 mol·L-1。则下列的叙述正确的是
17.一定量的混合气体,在密闭容器中发生如下反应:
xA(气)+yB(气) zC(气)达到平衡后,测得A的浓度为0.5 mol·L-1;在恒温下将密闭容器的体积扩大为平衡时的两倍,再达到平衡时,测得A的浓度为0.3 mol·L-1。则下列的叙述正确的是
A.x+y>z B.平衡向右移动
C.B的转化率提高 D.C的百分含量增大
18.在密闭容器内放入5molSO2和5molO2,在某温度下经过反应生成2molSO3,此时密闭容器内压强是反应前压强的
A.2倍 B.1.5倍 C.0.9倍 D.0.5倍
第Ⅱ卷 (非选择题 46分)
二、(本题包括3小题,共21分)
19.(6分)室温下,测得某溶液中[H+ ]=2×10-7 mol·L![]() ,则OH-的物质的量浓度为
,该溶液的PH为
(已知lg2=0.3)。
,则OH-的物质的量浓度为
,该溶液的PH为
(已知lg2=0.3)。
20.(6分)已知下列两个热化学方程式;
H2(g)+![]() O2(g)==H2O(1) △H = -286 kJ·mol-1
O2(g)==H2O(1) △H = -286 kJ·mol-1
C3H8(g)+5O2(g)==3CO2(g)+4H2O(1) △H = -2220.0 kJ·mol-1
(1)实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热5298kJ,则混合气体中H2和C3H8的体积比是 。
(2)已知:H2O(1)=H2O(g) △H = +44.0 kJ·mol-1,写出丙烷燃烧生成CO2和气态水的热化学方程式 。
21.(9分) 将等物质的量的A、B、C、D4种物质混合,发生如下反应:
aA+ bB ![]()
![]() c C(s)+dD。当反应进行一段时间后,测得A减少了n mol,B减少了0.5n
mol,C增加了1.5n
mol,D增加了n
mol,此时达到化学平衡。
c C(s)+dD。当反应进行一段时间后,测得A减少了n mol,B减少了0.5n
mol,C增加了1.5n
mol,D增加了n
mol,此时达到化学平衡。
(1)该化学方程式中各物质的系数为:a= ,b= , c= ,d=
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,该反应中各物质的聚集状态:A ,B , D
(3)若只升高温度,反应一段时间后,测知4种物质的物质的量又达到相等,则该反应为 反应。(填“放热”或“吸热”)
三、(本题15分)
22.(15分)已知A、B、C、D、E为五种短周期不同主族的元素,其原子序数依次递增。A、E两种原子最外层电子数之和是B原子最外层电子数的2倍;C、E两种原子最外层电子数之和是D原子最外层电子数的2倍。A、E形成的化合物分子甲中电子总数为18。A原子核内无中子,D是地壳中含量最多的元素。回答下列的问题。
(1)甲的电子式为
(2)工业生产E元素的单质的化学方程式为 。
(3)A单质与C单质在一定条件下可化合为乙,工业生产乙的化学方程式为
(4)A、B两元素也可形成多种化合物,其中分子量最小的分子为丙,用D的单质和丙可以制成燃料电池,电池中装有浓KOH溶液,用多孔的惰性电极浸入浓KOH溶液 在X极通入化合物丙,Y极通入D的单质,则X极是该电池的 极,Y极的电极反应式为 。
四、(本题10分)
23.(10分)黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。(1)将0.050molSO2(g) 0.030molO2(g)放入容积为1L的密闭容器中,反应2SO2(g)+O2(g)![]() 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol·L-1。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol·L-1。
(1)已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化的有 (填字母)。
A.升高温度 B.降低温度 C.增大压强
D.减小压强 E.加入催 F.移出氧气
(2)计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程。)
 高二化学上册第二次质量检测题
高二化学上册第二次质量检测题
化学答题卷
命题人:臧峰
一、选择题(本题包括18小题,每小题3分,共48分。每小题只有一个选项符合题意)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | |||||||||
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
二、(本题包括3小题,共21分)
19.(6分)
, 。
20.(6分)
(1)
(2) 。
21.(9分)
(1)a= ,b= , c= ,d=
(2)A ,B , D
(3) 。
三、(本题15分)
(1)
(2) 。
(3) 。
(4) 极, 。
四、(本题10分)
(1)
(2)解: