高二化学上学期期末五校联考试题
化 学 试 卷
出题人:兰考一高 曹永奇
试卷说明:1、本试卷满分100分,时间90分钟。
2、考试时,请将选择题答案涂在机读卡上,非选择题答在答案专页上。
3、题号前注有“※”的为课本原题,注有“▲”的为难度较大的题目。
4、可能用到的相对原子质量:H:1 C:12 O:16 Na:23 Mg:24 Al:27 Ca:40 Fe:56
第Ⅰ卷(选择题,共54分)
一、选择题(本题包括18小题,每小题3分,共54分。每小题仅一个选项符合题意。)
※1.有机物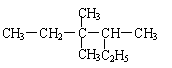 的正确命名为
的正确命名为
A.2-乙基-3,3-二甲基戊烷
B.3,3-二甲基-4-乙基戊烷
C.3,3,4-三甲基己烷
D.3,4,4-三甲基己烷
※2.与酸和碱都能反应的离子是
A.Al3+ B.Fe3+ C.AlO2- D.HCO3-
3.烯烃复分解反应的研究荣获了2005年诺贝尔化学奖,其反应可形象地描述为“交换舞伴”。催化剂金属卡宾(如CH2=M)与烯烃分子相遇后,“两对舞伴”会暂时组合起来,手拉手跳起“四人舞蹈”。随后它们“交换舞伴”,组合成两个新分子,其中一个是新的烯烃分子,另一个是新的金属卡宾。后者会继续寻找下一个烯烃分子,再次“交换舞伴”。若把C6H5CH2CH=CH2与CH2=M在一定条件下混合反应,下列产物不可能生成的是
A.C6H5CH2CH=M B.CH2=CH2
C.C6H5CH=CHC6H5 D.C6H5CH2CH=CHCH2C6H5
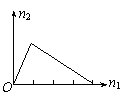
▲4.将物质X逐渐加入Y溶液中,生成沉淀的物质的量n2与所加X的物质的量n1的关系如下图所示,符合图示情况的是
| A | B | C |
| |
| X | NaOH | AlCl3 | HCl | NaAlO2 |
| Y | AlCl3 | NaOH | NaAlO2 | HCl |
※5.下列各组离子中,能在水溶液中大量共存的是
A. Ca2+、Na+、HCO3- B. Al3+、Ca2+、OH—
C. Mg2+、H+、 HCO3- D. Fe3+、 AlO2-、Cl-
6.将mg Al2O3、Fe2O3的混和物溶解在过量的100mLpH值为1的硫酸中,然后向其中加入NaOH溶液使Fe3+、Al3+刚好全部转化成沉淀,用去NaOH溶液100mL,则NaOH溶液的浓度为
A. 0.1mol/L B. 0.05mol/L
C. 0.2mol/L D. 无法计算
※7.把一块铁铝合金溶于足量的盐酸中,通入足量的氯气,再加入过量的氢氧化钠溶液,过滤,把滤渣充分灼烧,得到的固体残留物恰好跟原来的合金质量相等,则此合金中铁铝质量之比约为
A.1:1 B. 3:1 C. 7:3 D. 1:4
8.将pH=8的Ba(OH)2溶液加水稀释1000倍,稀释后所得溶液中Ba2+浓度与OH-浓度之比为
A. 1:2 B. 1:200
C.1:50 D. 1:100
※9. A、B、C都是金属,A中混有C时,A先腐蚀;A与B组成原电池时,A为电池的正极。ABC三种金属的活动性顺序为
A. A>B>C B. A>C>B
C. B>A>C D. B>C>A
▲10.相同物质的量浓度的NaCN和NaClO相比,NaCN溶液的pH较大,则同温同体积同浓度的HCN和HClO相比较,下列说法中正确的是
A. 电离程度:HCN>HClO B. 溶液的pH:HCN<HClO
C. 与NaOH溶液恰好完全反应时,消耗NaOH的物质的量:
HCN<HClO
D.酸根离子浓度: c (CN-)<c(ClO-)
※11. 在下列反应中,光照对反应几乎没有影响的是
A.氯气与氢气的反应 B.氯气与甲烷的反应
C.氧气与甲烷的反应 D.次氯酸的分解
▲12.某强酸溶液pH=a , 强碱溶液pH=b, 已知a+b=16,在常温下混合后pH=7,则酸溶液体积V酸和碱溶液的体积V碱的准确关系是:
A. V碱=102V酸 B. V酸=102V碱
C. V酸=2V碱 D. V碱=2V酸
※13.下列各对物质中,互为同系物的是
A.CH3-CH3和CH3-CH=CH2
B. CH3-CH=CH2和CH3-CH2CH=CH2
C. CH3-CH2-CH3和 CH3-CH=CH2
D.CH3-CH2-CH2-CH2-CH3和CH3-CH2-CH3
▲14.钢铁在国民建设中有着极其重要的作用,是目前应用最广泛的金属。在工业上,炼铁是以铁矿石为原料进行冶炼的。常见的铁矿石有赤铁矿(主要成分Fe2O3)、磁铁矿(主要成分Fe3O4)、菱铁矿(主要成分FeCO3)等。在等质量的上述三种矿石中,含铁量最高的是
A. 赤铁矿 B. 磁铁矿 C. 菱铁矿 D.无法确定
※15.1mol某烃完全燃烧可得2molCO2;在一定条件下,1mol该烃可以和2molH2发生加成反应,则该烃是
A. CH4 B. C2H4 C. C2H2 D. C3H4
▲16.有一种锂电池,它是用金属锂和石墨作电极材料,电解质溶液是由四氯化铝锂(LiAlCl4)溶解在亚硫酰氯(SOCl2)中形成的,电池总反应方程式为:8Li+3SOCl2=6LiCl+Li2SO3+2S。下列有关叙述中,正确的是
A.金属锂作电池的正极,石墨作电池的负极
B.电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3
C.电解质溶液中混入水,对电池反应无影响
D.电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4∶1
▲17.已知C—C键可以绕键轴自由旋转,对于结构简式为:
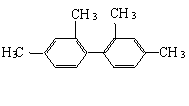 的烃,下列说法正确的是
的烃,下列说法正确的是
A.该烃属于苯的同系物
B.分子中至少有9个碳原子处于同一平面上
C.分子中至少有11个碳原子处于同一平面上
D.分子中至少有16个碳原子处于同一平面上
▲18.将一定量的有机物充分燃烧后的产物通入足量的石灰水中完全吸收,经过滤得到沉淀20g,滤液质量比原来石灰水减少5.8g,该有机物不可能为
A.CH3OH B.C2H5OH
![]() C.CH2—CH2
D.C2H6
C.CH2—CH2
D.C2H6
第Ⅱ卷(非选择题,共46分)
二.实验题(共两题20分)
19.(10分)利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验中模拟上述过程,其设计的模拟装置如下:
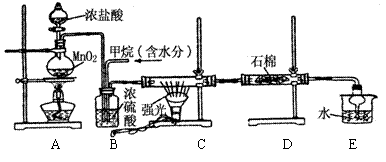 |
(1)B装置有三种功能:①___________;②___________
③_____________。
(2)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x值的取值范围为______。
(3)D装置的石棉中均匀混有KI粉末,其作用是_______ 。
(4)E装置的作用是 ,其中球形干燥管的作用是 。
A.收集气体 B.吸收氯气
C.防止倒吸 D.吸收氯化氢
(5)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式____________________________________。
(6)该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为______(填编号)
A.CH4 B.CH3Cl C.CH2Cl2
D.CHCl3 E.CCl4
20.(10分)某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如下图。加热聚丙烯废塑料得到的产物如下表:
| 产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
| 质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
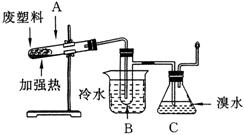
![]() (1)试管A中残余物有多种用途,如下列转化就可制取高聚物聚乙炔。
(1)试管A中残余物有多种用途,如下列转化就可制取高聚物聚乙炔。
写出反应②、③的化学方程式:
____________________________________________________;
____________________________________________________。
(2)试管B收集到的产品中,能使酸性高锰酸钾溶液褪色的物质,其一氯代物有___种。
(3)锥形瓶C中观察到的现象___________________________;经溴水充分吸收,剩余气体经干燥后的平均相对分子质量为______________。
三.填空、推断题(共3题20分)
※21.(4分)钢铁表面易发生吸氧腐蚀。发生腐蚀时,铁是
极,电极反应式为 ;杂质碳是 极,电极反应式为 。
22.(8分)在恒温时,某容积为V L的密闭容器中通入2 moL X和1 moL Y气体,发生如下反应:2X(g)+Y(g)![]() 2Z(g),压强一定时,测得在平衡时Z的体积分数为0.4。
2Z(g),压强一定时,测得在平衡时Z的体积分数为0.4。
(1)若与上述平衡保持同温、同压,另取4 moL X(气)和2 moL Y(气)达平衡,则Z的体积分数为 平衡时,气体的总物质的量为 ;
▲(2)若与上述平衡保持同温、同压,于一密闭容器中充入X(气)和Y(气)的物质的量分别记为a、b,平衡时Z的体积分数也恰好为0.4。若恒有m< ![]() < n,则 :
< n,则 :
m = ,n = 。
▲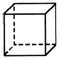 23.(8分) “立方烷”是一种新合成的烃,其分子为正方体结构,其碳架结构如右图所示。
23.(8分) “立方烷”是一种新合成的烃,其分子为正方体结构,其碳架结构如右图所示。
①立方烷的分子式为_______________;
②该立方烷的二氯代物具有同分异构体的数目是_______;
③该立方烷的六氯代物具有的同分异构体数目是_______;
④将a g立方烷溶于b mL苯中,然后通入c L乙炔(标准状况),所得混合物中碳的百分含量为________________。
四.计算题(共一题6分)
24.(6分)某烃的蒸气对H2的相对密度为60,它含碳90%。
(1)该烃的分子式为_____________。
(2)已知该烃能被酸性高锰酸钾溶液氧化,且氧化后的产物可被氢氧化钠溶液中和。经推算,氧化后产物的相对分子质量为166,写出该烃可能的结构简式:
________________________________________________________
| 座号 |
|
化学答案专页
第Ⅱ卷(非选择题,共46分)
| 二 | 三 | 四 | 总分 | |
| 得 分 |
二、实验题
19.(1)① ②
③
(2) (3)
(4)
(5) (6)
20.(1)
(2) (3)
三、填空、推断
21.
22.(1) (2)m = ,n=
23.(1) (2) (3) (4)
四、计算题
24.(1)
(2)
。
 D
D