高二化学上学期期末复习试题
化学试题(化学反应速率和化学平衡D卷)
1. 本题列举的四个选项是4位同学在学习“化学反应速率和化学平衡”专题后,联系工业生产实际所发表的观点,你认为不正确的是 ( )
A. 化学反应速率理论是研究怎样在一定时间内快出产品
B. 化学平衡理论是研究怎样使用有限原料多出产品
C. 化学反应速率理论是研究怎样提高原料转化率
D. 化学平衡理论是研究怎样使原料尽可能多地转化为产品
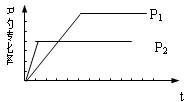 2.有A(g)+ 2 B(g)
2.有A(g)+ 2 B(g)![]() x C(g)的可逆反应,在不同的压强(P1、P2)下测得B的转化率与时间的关系如图曲线所示,以下结论中,正确的是
( )
x C(g)的可逆反应,在不同的压强(P1、P2)下测得B的转化率与时间的关系如图曲线所示,以下结论中,正确的是
( )
A.P1>P2,x>3 B.P1<P2,x>3
C.P1>P2,x<3 D.P1<P2,x<3
3.某温度下,在一容积可变的容器中,反应2A(g)+B(g) ![]() 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是
( )
2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是
( )
A.均减半 B.均加倍 C.均增加1mol D.均减少1mol
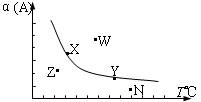 4. 在其他条件一定时,反应2A+B
4. 在其他条件一定时,反应2A+B![]() 2C中,A的最大转化率与温度的关系曲线如图,下列叙述正确的有
( )
2C中,A的最大转化率与温度的关系曲线如图,下列叙述正确的有
( )
A.X或Y两点相应的v(正)=v(逆),吸热反应
B.Z、N两点表示未达平衡状态,且都是v(正) > v(逆)
C.W点表示非平衡状态,v(正) > v(逆)
D.相应反应速率大小的点:W>Y>N
5.已知:(NH4)2CO3(S)=NH4HCO3(S)+NH3(g) △H=+74.9kJ/mol,下列说法中正确的是( )
A.该反应是吸热反应,因此一定不能自发进行
B.该反应中熵变、焓变皆大于0
C.碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解一定自发
D.能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应
6.有两只密闭容器甲和乙,甲容器有一个可移动的活塞,能使容器内保持恒压,乙容器能保持恒容。起始时分别向两容器内充入2molSO2和1molO2,在相同的温度和压强下开始发生下列反应:2SO2+O2![]() 2SO3,并达到平衡。下列叙述不正确的是( )
2SO3,并达到平衡。下列叙述不正确的是( )
A.平均反应速率:甲>乙 B.平衡时O2的物质的量:甲<乙
 C.平衡时SO2的转化率:甲>乙 D.平衡时SO3的体积分数:甲<乙
C.平衡时SO2的转化率:甲>乙 D.平衡时SO3的体积分数:甲<乙
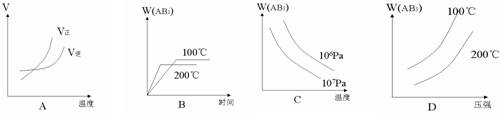
7. 对于可逆反应,A2(g)+3B2(g) ![]() 2AB3(g)△H<0,下列图像不正确的是( )
2AB3(g)△H<0,下列图像不正确的是( )
8. 某温度下,密闭容器中发生反应 a X (g) ![]() b Y (g) + c Z (g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是 ( )
b Y (g) + c Z (g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是 ( )
A. 可逆反应的化学计量数:a>b+c B. 压缩容器的容积时,υ正增大,υ逆减小
C. 达到新平衡时,物质X的转化率减小 D. 达到新平衡时,混合物中Z的质量分数增大
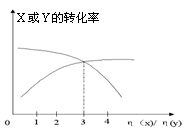 9.一定条件下,将X和Y两种物质按不同比例放入密闭容器中,反应达到平衡后,测得X、Y转化率与起始时两种物质的物质的量之比n(x)/n(y)关系如图,则x和y反应的方程式可表示为 ( )
9.一定条件下,将X和Y两种物质按不同比例放入密闭容器中,反应达到平衡后,测得X、Y转化率与起始时两种物质的物质的量之比n(x)/n(y)关系如图,则x和y反应的方程式可表示为 ( )
A.X + 3Y ![]() 2Z B.3X+Y
2Z B.3X+Y![]() 2Z
2Z
C.3X + 2Y ![]() Z D.6X+ 2Y
Z D.6X+ 2Y ![]() Z
Z
 10. 某可逆反应L(s) +
G(g)
10. 某可逆反应L(s) +
G(g) ![]() 3R(g)ΔH>0(正反应为吸热反应), 右图表示外界条件温度、压强的变化对上述反应的影响。试判断图中Y轴可以表示
( )
3R(g)ΔH>0(正反应为吸热反应), 右图表示外界条件温度、压强的变化对上述反应的影响。试判断图中Y轴可以表示
( )
A.平衡混合气中R的质量分数 B.达到平衡时G的转化率
C.平衡混合气中G的质量分数 D.达到平衡时L的转化率
11. 一定温度下的某固定密闭容器中,1 mol X和n mol Y发生如下可逆反应:
X(g)+Y(g)![]() 2Z(g)+W(s);ΔH>0。一段时间达到平衡后,生成a mol Z。则下列叙述正确的是( )
2Z(g)+W(s);ΔH>0。一段时间达到平衡后,生成a mol Z。则下列叙述正确的是( )
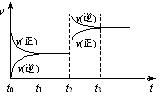 A.起始时刻和达平衡后容器中压强之比为a:(1+n)
A.起始时刻和达平衡后容器中压强之比为a:(1+n)
B.达平衡时,物质X和Y的转化率之比为n:1
C.平衡后若加入X,上述反应的ΔH会增大
D.平衡后若加入少量W,反应速率变化如图所示,平衡逆向移动
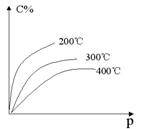 12. 反应mA(固)+nB(气)
12. 反应mA(固)+nB(气) ![]() eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是( )
eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是( )
A.达到平衡后,加入催化剂则C%增大
B.达到平衡后,若升温,平衡左移
C.化学方程式中n>e+f
D.达到平衡后,增加A的量有利于平衡向右移动
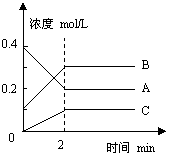 13. 右图所示为800℃时A、B、C三种气体在密闭容器中反
13. 右图所示为800℃时A、B、C三种气体在密闭容器中反
应时浓度的变化。只从图上分析不能得出的结论是( )
A. A是反应物
B.前2 min A的分解速率为0.1mol·L-1·min-1
C.达平衡后,若升高温度,平衡向正反应方向移动
D.达平衡后,若增大压强,平衡向逆反应方向移动
![]()
![]()
![]()
 14.某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):
14.某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):
根据以上规律判断,下列结论正确的是( )
A.反应Ⅰ:△H>0,P2>P1 B.反应Ⅱ:△H<0,T1>T2
C.反应Ⅲ:△H>0,T2>T1;或△H<0,T2<T1 D.反应Ⅳ:△H<0,T2>T1
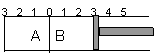 15. 如图所示,温度不变下某容器分隔成A、B两部分,A容器固定不变,B有可移动的活塞,现在A中充入2molSO2和1molO2,在B中充入2 molSO3和1molN2,在相同条件下发生可逆反应:2SO2(g)+O2(g)
15. 如图所示,温度不变下某容器分隔成A、B两部分,A容器固定不变,B有可移动的活塞,现在A中充入2molSO2和1molO2,在B中充入2 molSO3和1molN2,在相同条件下发生可逆反应:2SO2(g)+O2(g) ![]() 2SO3(g),根据下列要求填空:
2SO3(g),根据下列要求填空:
(1)固定活塞位置在3处不动,达到平衡后,设A中压强为PA,B中压强为PB,则PA与PB的压强是PA PB (填“<”、“>”、“=”)。
(2)若要使A中与B中平衡状态相同,可移动活塞的位置应在 处。
(3)若活塞右移到5处,达到平衡后,B中SO3为x mol,A中SO3为y mol,则x y (填“<”、“>”、“=”),理由是 。
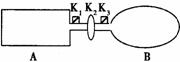 16.A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充人A、B中,反应起始时,A、B的体积均为VL。
16.A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充人A、B中,反应起始时,A、B的体积均为VL。
(已知:2NO2 ![]() N2O4;△H<0。忽略气球材料对平衡移动的影响 )
N2O4;△H<0。忽略气球材料对平衡移动的影响 )
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是v(A) v(B)。(填“>”、“<”、“=”);若打开活塞K2,气球B将 (填:变大、变小、不变)。
(2)若在A、B中再充人与初始量相等的NO2,则达到平衡时,NO2的转化率α(A)将 (填增大或减小、不变,下同);若通人等量的Ne气,则达到平衡时,A中NO2的转化率将 ,B中NO2的转化率将 。
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时, 中的颜色较深。
17.在密闭容器中,将1.0mol CO与1.0mol H2O混合加热到800℃,发生下列反应:
CO(g)+H2O(g)![]() CO2(g)+H2(g)一段时间后该反应达到平衡,测得CO的物质的量为0.5mol。回答下列问题:
CO2(g)+H2(g)一段时间后该反应达到平衡,测得CO的物质的量为0.5mol。回答下列问题:
①平衡时CO的转化率为 ,该反应的化学平衡常数为 。
②如果继续向该平衡体系中通入1.0mol的H2O(g),相同条件下反应达到新的平衡状态,则CO的转化率将 (填“增大”、“减小”、“不变”),预计CO的转化率为 。
③427℃时该反应的平衡常数为9.4,请结合①中的计算结果判断该反应的△H 0(填“>”、“==”、“<”)。
④若800K时,起始浓度c(CO)=a mol/L,c(H2O)=b mol/L,H2的平衡浓度c(H2)=c mol/L,
①a、b、c之间的关系式是 ;②当a=b时,a= c。
![]() 18.对于可逆反应:mA(g)+ nB(g) pC(g) + qD(g)达平衡时,V正=k1C(A)
m C(B) n
18.对于可逆反应:mA(g)+ nB(g) pC(g) + qD(g)达平衡时,V正=k1C(A)
m C(B) n
(K1为速率常数),达平衡时,K2 = { c(C)} p ×{ c(D)}q (K2为化学平衡常数),
{ c(A)}m ×{ c(B)}n
且K1、K2只与温度有关。现将4molSO2与2molO2充入体积为2L的密闭容器中,500℃进行反应并保持温度不变,反应达到平衡时,SO2的转化率为50%。
则:⑴起始时正反应速率是平衡时的 倍。
⑵500℃时,该反应的平衡常数K2是
⑶在温度不变时,再向平衡体系中加入2molSO2 、2molO2与4molSO3,平衡将向 移动。
化学反应速率和化学平衡D卷参考答案
1. C 2.B 3.C 4.B 5.B 6.D 7.AC
8.C 9.BD 10.C 11.B 12.BC 13.C 14.BC
15.<、3、x<y
16.<、变小
增大、不变、减小
A
17.50%、1
增大、66.7%
<
Ac+bc=ab、2
18.8、2、正方向