高二化学反应与能量变化单元测验题
(由简荣羡老师编写)
一、选择题(每题有1~2个答案)
1.下列说法正确的是 ( )
A.热化学方程式中,化学式前面的化学计量数既可表示微粒数,又可表示物质的量。
B.热化学方程式中,如果没有注明温度和压强,则表示在标准状况下测得的数据。
C.书写热化学方程式时,不仅要写明反应热的符号和数值,还要注明各物质的聚集状态。
D.凡是化合反应都是放热反应,分解反应都是吸热反应。
2.下列说法不正确的是( )
A.化石燃料在任何条件下都能充分燃烧
B.化石燃料在燃烧过程中能产生污染环境的CO、SO2等有害气体
C.直接燃烧煤不如将煤进行深加工后再燃烧的效果好
D.固体煤变为气体燃料后,燃烧效率将提高
3、未来新能源的特点是资源丰富,在使用时对环境无污染或很少污染,且有些可以再生。下列属最有希望的新能源的是( )
①天然气 ②煤 ③核能 ④水电 ⑤太阳能 ⑥燃料电池 ⑦风能 ⑧氢能
A.①②③④ B.⑤⑥⑦⑧ C.③④⑤⑥ D.除①②外
4、下列说法不正确的是( )
A、放热反应不需要加热即可发生
B、化学反应过程中的能量变化除了热能外,还可以是光能、电能等
C、需要加热才能进行的反应不一定是吸热反应
D、化学反应热效应数值与参加反应的物质的多少有关
5、下列性质中,能说明乙醇宜作燃料的是( )
①燃烧时发生氧化还原反应 ②充分燃烧时的产物不污染环境
③乙醇是一种再生能源 ④燃烧时放出大量的热
A、①②③④ B、①②④ C、①③④ D、②③④
6、“摇摇冰”是一种即用即饮的饮料。吸食时,将饮料罐隔离层中的化学物质和水混合后摇动即会制冷。该化学物质是 ( )
A、氯化钠 B、固体硝酸铵 C、生石灰 D、蔗糖
7、将铁粉和硫混合后加热,待反应一发生即停止加热,反应仍可持续进行,直至反应完全生成新物质硫化亚铁,该现象说明了( )
A、该反应是吸热反应 B、该反应是放热反应
C、铁粉和硫粉在常温下难以发生反应
D、生成硫化亚铁的总能量高于反应物铁粉和硫粉的总能量
8.已知
(l)![]() =H2O(g) △H1=a
kJ·
=H2O(g) △H1=a
kJ·![]()
(2)![]() =2H2O(g) △H2=b kJ·
=2H2O(g) △H2=b kJ·![]()
(3)![]() =H2O(l) △H3=c
kJ·
=H2O(l) △H3=c
kJ·![]()
(4)![]() =2H2O(l) △H4=d
kJ·
=2H2O(l) △H4=d
kJ·![]()
下列关系式中正确的是 ( )
A. a<c <0 B.b>d>0 C.2a=b<0 D.2c=d>0
9.1g碳与适量水蒸气反应生成CO和H2,需吸收10.94kJ热量,此反应的热化学方程式为( )
A.C + H2O == CO + H2 ΔH== +131.3kJ·mol—1
B. C(s)+ H2O(g) == CO(g) + H2(g) ΔH== +10.94kJ·mol—1
C. C(s)+ H2O(l) == CO(g) + H2(g) ΔH== +131.3kJ·mol—1
D. C(s)+ H2O(g) == CO(g) + H2(g) ΔH== +131.3kJ·mol—1
10.甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水时放出222.5kJ热量,则下列热化学方程式中正确的是( )
A.2CH4(g) + 4O2(g) == 2CO2(g) + 4H2O(l) ΔH== +890kJ·mol—1
B. CH4(g) + 2O2(g) == CO2(g) +2H2O(l) ΔH== +890kJ·mol—1
C. CH4(g) + 2O2(g) == CO2(g) +2H2O(l) ΔH==-890kJ·mol—1
D. 2CH4(g) + 4O2(g) == 2CO2(g) + 4H2O(l) ΔH==-890kJ·mol—1
11、下列热化学方程式书写正确的是( )
A、2SO2+O2=2SO3 △H= -196.6kJ/mol
B、2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ/mol
C、H2(g)+![]() O2(g)=H2O(l) △H=-285.8kJ
O2(g)=H2O(l) △H=-285.8kJ
D、C(s)+O2(g)=CO2(g) △H=+393.5kJ/mol
12、下列几个热化学方程式,△H能表示固体C或H2的燃烧热的是( )
A、C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol
B、C(s)+1/2O2(g)=CO(g) △H=-110.5kJ/mol
C、2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ/mol
D、H2(g)+1/2O2(g)=H2O(g) △H=-241.8kJ/mol
13、下列说法正确的是( )
A、CH4(g) + ![]() O2(g) ==
CO(g) +2H2O(l)
ΔH== -akJ·mol—1
,这ΔH代表燃烧热
O2(g) ==
CO(g) +2H2O(l)
ΔH== -akJ·mol—1
,这ΔH代表燃烧热
B、在250C、101kPa,1molS和2molS的燃烧热相等
C、CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,所以CO的燃烧反应
一定是吸热反应
D、101kPa时,1mol碳燃烧所放出的热量为碳的燃烧热
14.已知一定条件下,有下列反应(相同质量的金刚石、石墨完全反应)
C(石墨)+O2(g)=CO2(g) △H=-393.5kJ/mol
C(金刚石)+O2(g)=CO2(g) △H=-395.0kJ/mol
据此判断,下列说法正确的是( )
A.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低
B.由石墨制备金刚石是吸热反应,等质量时,石墨的能量比金刚石的高
C.由石墨制备金刚石是放热反应,等质量时,石墨的能量比金刚石的低
D.由石墨制备金刚石是放热反应,等质量时,石墨的能量比金刚石的高
15.已知破坏1molH—H键要吸收的能量为为436 KJ,破坏1molH—N键需要吸收的能量为391KJ,又已知热程式:N2 (g)+3H2 (g)= 2NH3(g) ΔH=-92.4 KJ/mol,则破坏1molN≡N键的需要消耗的能量为 ( )
A.431 KJ/mol B.946 KJ/mol C.649 KJ/mol D.869 KJ/mol
16.强酸和强碱的稀溶液的中和热可表示为:
H+(aq)+OH-(aq)=H2O(1) △H =-57.3kJ/mol
已知:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O △H =- Q1kJ/mol
![]() H2SO4(浓) + NaOH(aq) =
H2SO4(浓) + NaOH(aq) =![]() Na2SO4(aq) +H2O(1)
△H
=- Q2kJ/mol
Na2SO4(aq) +H2O(1)
△H
=- Q2kJ/mol
HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(1) △H =- Q3kJ/mol
上述反应均为溶液中的反应,则Q1、Q2、Q3的绝对值大小的关系为( )。
(A)Q1=Q2=Q3 (B)Q2>Q1>Q3 (C)Q2>Q3>Q1 (D)Q2=Q3>Q1
17.已知299 K时,合成氨反应 N2 (g ) + 3H2
( g )![]() 2NH3 ( g ) △H = -92.0 kJ/mol,将此温度下的1 mol N2 和3 mol H2 放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)
( )
2NH3 ( g ) △H = -92.0 kJ/mol,将此温度下的1 mol N2 和3 mol H2 放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)
( )
A.一定大于92.0 kJ B. 一定等于92.0 kJ C. 一定小于92.0 kJ D. 不能确定
二、填空题
18.(5分)把煤作为燃料可通过下列两种途径:
途径Ⅰ C(s)+O2(g)=====CO2(g);ΔH1<0 ①
途径Ⅱ 先制成水煤气:
C(s)+H2O(g)=====CO(g)+H2(g);ΔH2>0 ②
再燃料水煤气:
2CO(g)+O2(g)=====2CO2(g);ΔH3<0 ③
2H2O(g)+O2(g)=====2H2O(g);ΔH4<0 ④
请回答下列问题:
(1)途径Ⅰ放出的热量理论上_________(填“大于”“等于”或“小于”)途径Ⅱ放出的热量。
(2)ΔH1、ΔH2、ΔH3、ΔH4的数学关系式是_______________。
19.(7分)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式_______________________
_ 。若1g水蒸气转化成液态水时放热2.444KJ,则反应H2(g) +
1/2O2(g) == H2O(l)的△H=______________ kJ·![]() 。氢气的燃烧热为___________kJ·
。氢气的燃烧热为___________kJ·![]()
20、(7分)已知 P4(白磷,s) + 5O2 = 2P2O5(s)
ΔH=-2983.2kJ·![]()
4P(红磷,s)+ 5O2
= 2P2O5 (s) ΔH=-738.5kJ·![]()
则白磷转化为红磷的热化学方程式为______________________________________
相同状态下,能量状态较低的是___________,白磷的稳定性比红磷_______(填高或低)
21.(8分)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652KJ的热量。
(1)反应的热化学方程式为 ___________________________ 。
(2)又已知H2O(l)=H2O(g);ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 ________ KJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是
________________________________ 。
三、实验题
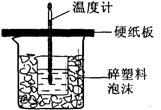 19.中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量。某学生想通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:
19.中和热是指酸跟碱发生中和反应生成lmol H2O所放出的热量。某学生想通过测定反应过程中所放出的热量来计算中和热。他将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:
(1) 从实验装置上看,图中尚缺少的一种玻璃用品是__________________,烧杯间填满碎塑料泡沫的作用是_________________________________________。
(2) 大烧杯上如不盖硬纸板,则求得的中和热数值_________(填“偏大”、“偏小’、“无影响”)
(3) 实验中NaOH的稍过量的,目的是__________________________________
(4)实验测量的数据如下表格,则根据测量数据计算出生成1molH2O的反应热是_______
(5)实验中改用60 mL 0.50 mol/L的盐酸跟50mL 0.55 mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量______________(填“相等”或“不相等”),理由是______________________________________________________________________;所求中和热的数值会________(填“相等”或“不相等”),理由是_______________________________________________________________________。
(6)实验探究:中和反应是放热反应
同学甲用温度计测量出一烧杯中的稀盐酸的溶液的温度为t1,然后加入NaOH固体,再测量混合溶液的温度t2,发现t2>t1,于是甲马上得出结论:中和反应是放热反应,
乙同学认为甲同学的结论不一定正确,原因________________________________;
为了证明中和反应确实是放热反应,你觉得甲的实验方案该如何改进?请你简单写出你改进后的方案:
__________________________________________________________________
__________________________________________________________________
20、(7分)化学能与热能转化的实验观察。
(1)按图所示将实验装置连接好。
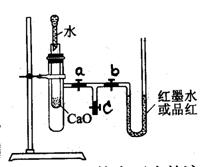
(2)在U型管内加入少量品红溶液(或红墨水)。打开3个T型管螺旋夹,使U型管内两边的液面处于同一水平面,再夹紧螺旋夹。
(3)在中间的试管里盛1g氧化钙,当滴入2mL左右的蒸馏水后,打开a、b螺旋夹,可观察到U型管里的红墨水____________________________________________________。
(4)也可以在小试管里盛—————————————固体或————————————粉末,滴入3%的过氧化氢溶液,反应时都会使U型管内侧的液面立即____________________,外侧的液面—————————————。
(5)要用这个装置观察到U型管内出现与上述(4)相反的现象,可以在小试管中加入—————____________________固体和注入____________________________浓溶液。
20.一些盐的结晶水合物,在温度不太高时就有熔化现象,既熔融于自身的结晶水中,又同时吸收热量。它们在塑料袋中经日晒能熔化,在日落后又可缓慢凝结而释放热量,用以调节室温,称为潜热材料。现有几种盐的水合晶体,有关数据如下:
| Na2S203·5H2O | CaCl2·6H2O | Na2SO4·10H20 | Na2HPO4·12H20 | |
| 熔点(℃) | 40~50 | 29.92 | 32.38 | 35.1 |
| 熔化热(kJ/mol) | 49.7 | 37.3 | 77 | 100.1 |
(1)上述潜热材料中最适宜应用的两种盐是______________________(用化学式表示)。
(2)实际应用时最常采用的______________________ (由来源和成本考虑)。
四、计算题(要求写出过程,不写过程不给分)
21.已知下列各组热化学方程式
(1)Fe2O3(s)+3CO(g)=2Fe(s)+3CO2 △H=-25kJ/mol
(2)3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H=-47kJ/mol
(3)Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+19kJ/mol
请写出FeO(s)被CO(g)还原成Fe和CO2(g)的热化学方程式。(要求有过程)
22、NH3(g)燃烧生成NO2和H2O(g),已知
(1)2H2 ( g ) + O2 ( g ) = 2H2O ( g ) △H = -483.6 kJ/mol
(2)N2 ( g ) + 2O2 ( g ) = 2NO2 ( g) △H = +67.8kJ/mol
(3) N2 ( g ) + 3H2 ( g ) = 2NH3 ( g) △H = -92.0kJ/mol
(4)H2O(l)=H2O(g); ΔH=+44kJ/mol
则NH3(g)的燃烧热是_______________________
23.(7分)已知:2H2 ( g ) + O2 ( g ) = 2H2O ( l ) △H = -571.6 kJ/mol
2H2 ( g ) + O2 ( g ) = 2H2O ( g ) △H = -483.6 kJ/mol
CH4 ( g ) + 2O2 ( g ) = 2H2O ( l ) + CO2 ( g ) △H = -890 kJ/mol
常温下,取甲烷和氢气的混合气体11.2 L(标准状况下)经完全燃烧后恢复到常温,则放出的热量为64.18kJ,试求混合气体中甲烷和氢气体积比。
24、某石油液化气由丙烷和丁烷组成,其质量分数分别为80%和20%。它们燃烧的热化学方程式分别为:
C3H8(g)+5O2(g)==3CO2(g)+4H2O(1) △H=-2 200kJ/mol
C4H10(g)+![]() O2(g)==4CO2(g)+5H2O(1) △H=-2 900 kJ/mol
O2(g)==4CO2(g)+5H2O(1) △H=-2 900 kJ/mol
有一质量为0.80kg、容积为4.0L的铝壶,将一壶20℃的水烧开需消耗液化石油气0.056kg,试计算该燃料的利用率。[已知水的比热为4.2kJ/(kg·℃),铝的比热为0.88kJ/(kg·℃)]