高二化学水溶液中的电离平衡测试题
广州市中学化学教研会高二中心组提供
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Al 27 S 32 Cl 35.5
第一部分 选择题(共90分)
一、选择题(本题包括10小题,每小题4分,共40分。每小题只有一个选项符合题意)
1.有一支50mL酸式滴定管中盛盐酸,液面恰好在amL刻度处,把管内液体全部放出,盛入量筒内,所得液体体积一定是
A. a mL B.(50―a)mL
C. 大于(50―a)mL D. 大于a mL
2.用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是
A.![]() B.
B.![]()
C.c(H+)和c(OH-)的乘积 D.OH-的物质的量
3.某学生的实验报告所列出的下列数据中合理的是
A.用10mL量筒量取7.13mL稀盐酸
B.用托盘天平称量25.20g NaCl
C.用广泛pH试纸测得某溶液的pH为2.3
D.用25mL滴定管做中和滴定时,用去某浓度的碱溶液21.70mL
4.下列溶液加热蒸干后,能析出溶质固体的是
A.AlCl3 B.KHCO3 C.Fe2(SO4)3 D.NH4HCO3
5.在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH- 离子浓度分别为Amol/L与Bmol/L,则A和B关系为
A. A>B B. A=10-4 B C. B=10-4 A D. A=B
6.一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的
①NaOH固体 ②H2O ③NH4Cl固体 ④CH3COONa固体 ⑤NaNO3固体 ⑥KCl溶液
A.②④⑥ B.①② C.②③⑤ D.②④⑤⑥
7.1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH等于
A. 9.0 B. 9.5 C. 10.5 D. 11.5
8.含等物质的量NaOH的溶液分别用pH为2和3的CH3COOH溶液中和,设消耗CH3COOH溶液的体积依次为![]() ,则两者的关系正确的是
,则两者的关系正确的是
A. ![]() B.
B.
![]()
C. ![]() D.
D.
![]()
9.若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是
A.生成了一种强酸弱碱盐 B.弱酸溶液和强碱溶液反应
C.强酸溶液和弱碱溶液反应 D.一元强酸溶液和一元强碱溶液反应
10.下列溶液,一定呈中性的是
A. c(H+)=1×10-7mol/L的溶液
B. pH=pOH 的溶液
C. pH=14-pOH 的溶液
D. 由等体积、等物质的量浓度的一元酸跟氢氧化钠溶液混合后所形成的溶液
二、选择题(本题包括10小题,每小题5分,共50分,每小题有一个或两个选项符合题意)
11.25℃时,在某物质的溶液中,由水电离出的c(H+)=1×10-a mol/L,下列说法不正确的是
A.a<7时,水的电离受到抑制 B.a>7时,水的电离受到抑制
C.a<7时,溶液的pH一定为a D.a>7时,溶液的pH一定为14-a
12.下列离子方程式中正确的是
A. 氢氧化钠溶液吸收过量的二氧化碳 OH-+CO2 = HCO3-
B. 亚硫酸氢铵溶液与足量氢氧化钠溶液反应 HSO3-+ OH-= SO32-+ H2O
C. 氯气通入冷水中 Cl2 +H2O = Cl- +ClO- +2H+
D. 碳酸镁悬浊液中加醋酸 CO32-+2CH3COOH = 2CH3COO-+CO2↑+H2O
13.氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是
A. 1mol/L甲酸溶液的pH约为3
B. HCN易溶于水
C. 10 mL1mol/LHCN恰好与10 mL 1mol/L NaOH溶液完全反应
D. 在相同条件下,HCN溶液的导电性比强酸溶液的弱
14. 已知当NH4Cl溶液的浓度小于0.1mol/L时,其pH>5.1。现用0.1mol/L的盐酸滴定10mL0.05mol/L的氨水,用甲基橙作指示剂达到终点时所用盐酸的量应是
A.10mL B.5mL C.大于5mL D.小于5mL
15.将40℃的饱和石灰水冷却至10℃;或加入少量CaO,但温度仍保持40℃,在这两种情况下均未改变的是
A.Ca(OH)2的溶解度、溶剂的质量 B.溶液中溶质的质量分数
C.溶液的质量、水的电离平衡 D.溶液中Ca2+的数目
16.将pH=11 NaOH溶液和pH=3的甲酸溶液以等体积混合后,对所得溶液,下列判断一定正确的是
A.c(HCOO-)< c(Na+) B.c(HCOO-)> c(Na+)
C.c(OH-)< c(HCOO-) D.c(OH-)> c(HCOO-)
17. 常温下,0.1 mol/L某一元酸(HA)溶液中![]() =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是
A.溶液中水电离出的c(H+)=10-10 mol/L
B.溶液中c(H+)+c(A-)=0.1 mol/L
C.溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大
D.与0.05mol/L NaOH溶液等体积混合后所得溶液中离子浓度大小关系为
c(A-)>c(Na+)>c(OH-)>c(H+)
18.某温度下,0.1 mol/L醋酸溶液的pH=3。将该温度下0.2 mol/L醋酸溶液和0.2mol/L醋酸钠溶液等体积混合后,混合液的pH=4.7。下列说法正确的是
A.该温度下,0.0l mol/L醋酸溶液的pH=4
B.该温度下,用0.1 mol/L醋酸和0.01 mol/L醋酸分别完全中和等体积0.1 mol/L的NaOH溶液,消耗两醋酸的体积比为1∶10
C.该温度下,0.2 mol/L醋酸溶液和0.4 mol/L醋酸钠溶液等体积混合后,混合液的pH<4.7
D.该温度下,0.2 mol/L醋酸溶液和0.4 mol/L醋酸钠溶液等体积混合后,混合液的pH=4.7
19. 常温下pH=3的二元弱酸H2R溶液与a L pH=11的NaOH溶液混合后,混合液的pH刚好等于7(假设反应前后体积不变),则对反应后混合液的叙述正确的是
A. c(R2-)+ c(OH-)=c(Na+)+c(H+) B.c(R2-)>c(Na+)>c(H+)=c(OH-)
C. 2c(R2-)+ c(HR-)=c(Na+) D. 混合后溶液的体积为2a L
20.室温下,pH相同体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是
A. 加水稀释2倍后,两溶液的pH均减小
B. 使温度都升高20℃后,两溶液的pH均不变
C. 加适量的醋酸钠晶体后,两溶液的pH均增大
D. 加足量的锌充分反应后,醋酸产生的氢气比盐酸多
第二部分 非选择题(共60分)
三、(本题包括3小题,共34分)
21.(16分)
(1)AgNO3的水溶液呈 (填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示): ;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈 性 ,原因是(用离子方程式表示):
_____________________ _____________________________ 。
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的 。
22.(12分)
(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+) c(CH3COO-)(填“ >” 或“=”或“<” )。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 ,
溶液中c(Na+) c(CH3COO-)
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 ,醋酸体积 氢氧化钠溶液体积。
(4)将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后溶液的pH=7,则醋酸溶液中c(H+) 氢氧化钠溶液中c(OH-),m与n的大小关系是m n。
23.(6分)用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是 。
A. 配制标准溶液的氢氧化钠中混有Na2CO3杂质
B. 滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C. 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E. 未用标准液润洗碱式滴定管
 四、(本题包括2小题,共26分)
四、(本题包括2小题,共26分)
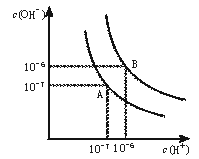
24.(8分)水的电离平衡曲线如下图所示。
(1)若以A点表示25℃时水在电离平衡时的离子浓度, 当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 。
(2)将常温下的pH=8的Ba(OH)2溶液与常温下的pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为 。
(3)已知AnBm的离子积=[c(Am+)]n·[c(Bn-)]m,式中c(Am+)n和c(Bn-)m表示离子的物质的量浓度。在某温度下,Ca(OH)2的溶解度为0.74 g,其饱和溶液密度设为1 g/mL,其离子积为 。
25.(18分)
(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号)__ __。
A.9 B.13 C.11~13之间 D.9~11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号)__ ___。
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小
(3)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),
①__ _和_ __两种粒子的物质的量之和等于0.1mol。
②_ __和_ __两种粒子的物质的量之和比OH―多0.05mol。
![]() (4)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
(4)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
①若溶液中只溶解了一种溶质,该溶质的名称是 ,上述离子浓度大小顺序关系中正确的是(选填序号) 。
②若上述关系中C是正确的,则溶液中溶质的化学式是 。
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)(填“>”、“<”、或“=”,下同) c(NH3·H2O),混合后溶液中c(NH4+)与c(Cl-)的关系c(NH4+) c(Cl-)。
选修4第三章《水溶液中的电离平衡》单元测试题答案
第一部分 选择题(共90分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | C | B | D | C | B | A | C | A | B | B |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | AD | A | AD | C | B | BC | C | BD | C | CD |
第二部分 非选择题(共60分)
三、(本题包括3小题,共34分)
21.(16分)(每空2分,共16分)
(1)酸,< ,Ag+ + H2O ![]() AgOH + H+ ,抑制 。
AgOH + H+ ,抑制 。
(2)酸,Al3++3H2O
![]() Al(OH)3+3H+, Al2O3 ;
Al(OH)3+3H+, Al2O3 ;
(3)NaOH。
22.(12分)(每题各3分,分别1分,2分)
(1)碱性,>; (2)酸性,<;
(3)中性,>; (4)<,>。
23.(6分)(每个2分,错选1个倒扣2分)
A、D、E
四、(本题包括2小题,共26分)
24.(8分)(每空2分,共8分)
(1)10-14 , 10-12 ; (2)2∶9; (3)0.004。
25.(18分)
(1)D(2分)
(2)C(2分)
(3)①NH3•H2O和NH4+(共2分,均答对给分)②NH4+和H+(共2分,均答对给分)
(4) ① 氯化铵 ,A (各2分)
② NH4Cl和HCl (2分)
③ < ,= (各2分)