高二化学溶液中离子浓度大小比较专题(用)
相关知识点:
1、电解质的电离
电解质溶解于水或受热熔化时,离解成能自由移动的离子的过程叫做电离。
强电解质如NaCl、HCl、NaOH等在水溶液中是完全电离的,在溶液中不存在电解质分子。弱电解质在水溶液中是少部分发生电离的。25℃0.1mol/L的如CH3COOH溶液中,CH3COOH的电离度只有1.32%,溶液中存在较大量的H2O和CH3COOH分子,少量的H+、CH3COO-和极少量的OH-离子。多元弱酸如H2CO3还要考虑分步电离:
H2CO3![]() H++HCO3-;HCO3-
H++HCO3-;HCO3- ![]() H++CO32-。
H++CO32-。
2、水的电离
水是一种极弱的电解质,它能微弱地电离,生成H3O+和OH-,H2O ![]() H++OH-。在25℃(常温)时,纯水中[H+]=[OH-]=1×10-7mol/L。
H++OH-。在25℃(常温)时,纯水中[H+]=[OH-]=1×10-7mol/L。
在一定温度下,[H+]与[OH-]的乘积是一个常数:水的离子积Kw=[H+]·[OH-],在25℃时,Kw=1×10-14。
在纯水中加入酸或碱,抑制了水的电离,使水的电离度变小,水电离出的[H+]水和[OH-]水均小于10-7mol/L。在纯水中加入弱酸强碱盐、弱碱强酸盐,促进了水的电离,使水的电离度变大,水电离出的[H+]水或[OH-]均大于10-7mol/L。
3、盐类水解
在溶液中盐的离子跟水所电离出的H+或OH-生成弱电解质的反应,叫做盐类的水解。
强酸弱碱盐如NH4Cl、Al2(SO4)3等水解后溶液呈酸性;强碱弱酸盐如CH3COONa、Na2CO3等水解后溶液呈碱性。多元弱酸盐还要考虑分步水解,如CO32-+H2O![]() HCO3-+OH-、HCO3-+H2O
HCO3-+OH-、HCO3-+H2O![]() H2CO3+OH-。
H2CO3+OH-。
4、电解质溶液中的守恒关系
电荷守恒:电解质溶液中所有阳离子所带有的正电荷数与所有的阴离子所带的负电荷数相等。
如NaHCO3溶液中:n(Na+)+n(H+)=n(HCO3-)+2n(CO32-)+n(OH-)推出:[Na+]+[H+]=[HCO3-]+2[CO32-]+[OH-]
如Na2CO3溶液中:c(Na+) +c(H+)=2c(CO32-)+c(OH-)+c(HCO3-)
物料守恒:电解质溶液中由于电离或水解因素,离子会发生变化变成其它离子或分子等,但离子或分子中某种特定元素的原子的总数是不会改变的。
如NaHCO3溶液中n(Na+):n(c)=1:1,推出:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
如HAc 溶液中:c(HAc)总=c(HAc)+c(Ac-);
水的电离守恒(也称质子守恒):是指在强碱弱酸盐或强酸弱碱盐溶液中,由水所电离的H+与OH-量相等。
如在0.1mol·L-1的Na2S溶液中:c(OH-)=c(H+)+c(HS-)+2c(H2S)。
质子守恒:电解质溶液中分子或离子得到或失去质子(H+)的物质的量应相等。例如在NH4HCO3溶液中H3O+、H2CO3为得到质子后的产物;NH3、OH-、CO32-为失去质子后的产物,故有以下关系:
c(H3O+)+c(H2CO3)=c(NH3)+c(OH-)+c(CO32-)。
解题指导
电解质溶液中离子浓度大小比较问题,是高考的“热点”之一。 多年以来全国高考化学试卷年年涉及这种题型。这种题型考查的知识点多,灵活性、综合性较强,有较好的区分度,它能有效地测试出学生对强弱电解质、电离平衡、电离度、水的电离、pH值、离子反应、盐类水解等基本概念的掌握程度及对这些知识的综合运用能力。
首先必须有正确的思路:
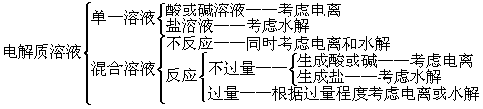
其次要掌握解此类题的三个思维基点:电离、水解和守恒(电荷守恒、物料守恒及质子守恒)。对每一种思维基点的关键、如何切入、如何展开、如何防止漏洞的出现等均要通过平时的练习认真总结,形成技能。
第三,要养成认真、细致、严谨的解题习惯,要在平时的练习中学会灵活运用常规的解题方法,例如:淘汰法、定量问题定性化、整体思维法等。
例题分析
例1:在氯化铵溶液中,下列关系式正确的是【 】
A.[Cl-]>[NH4+]>[H+]>[OH-] B.[NH4+]>[Cl-]>[H+]>[OH-]
C.[Cl-]=[NH4+]>[H+]=[OH-] D.[NH4+]=[Cl-]>[H+]>[OH-]
解析: NH4Cl是可溶性的盐,属于强电解质,在溶液中完全电离NH4Cl=NH4++Cl-。因为NH4Cl是强弱碱所生成的盐,在水中要发生水解;NH4++H2O
![]() NH3·H2O+H+,所以[NH4+]比[H+]及[OH-]大得多;溶液因水解而呈酸性,所以[H+]>[OH-]。综合起来,不难得出:[Cl-]>[NH4+]>[H+]>[OH-]。答案为A。
NH3·H2O+H+,所以[NH4+]比[H+]及[OH-]大得多;溶液因水解而呈酸性,所以[H+]>[OH-]。综合起来,不难得出:[Cl-]>[NH4+]>[H+]>[OH-]。答案为A。
例2:在0.1 mol/l的NH3·H2O溶液中,下列关系正确的是【 】
A.[NH3·H2O]>[OH-]>[NH4+]>[H+] B.[NH4+]>[NH3·H2O]>[OH-]>[H+]
C.[NH3·H2O]>[NH4+]=[OH-]>[H+] D.[NH3·H2O]>[NH4+]>[H+]>[OH-]
解析: NH3·H2O是一元弱酸,属于弱电解质,在水溶液中少部分发生电离(NH3·H2O
![]() NH4++OH-),所以[NH3·H2O]必大于[NH4+]及[OH-]。因为[OH-]=[H+]+[NH4+],所以[OH-]>[NH4+]。综合起来,[NH3·H2O]>[OH-]>[NH4+]>[H+]。答案为A。
NH4++OH-),所以[NH3·H2O]必大于[NH4+]及[OH-]。因为[OH-]=[H+]+[NH4+],所以[OH-]>[NH4+]。综合起来,[NH3·H2O]>[OH-]>[NH4+]>[H+]。答案为A。
例3:(2000年春季高考)用1L10mol/LNaOH溶液吸收0.8molCO2,所得溶液中CO32-和HCO3-的物质的量浓度之比是 【 】
A.1:3
B.2:1
C.2:3 D.3:2
解析:设反应生成的Na2CO3的物质的量为x,生成的NaHCO3的物质的量为y。
2x+y=10mol/L×1L(Na+守恒)
x+y=0.8mol(C守恒)
求出:x=0.2mol,y=0.6mol。
则 c(CO32-):c(HCO3-)=1:3,选A。
例4:(1999年上海高考)
把0.02mol/LHAc溶液和0.01mol/LNaOH溶液
等体积混合,则混合溶液中微粒浓度关系正确的是【 】
A.c(Ac-)>c(Na+) B.c(HAc)>c(Ac-)
C.2c(H+)=c(Ac-)-c(HAc)
D.c(HAc)+ c(Ac-)=0.01mol/L
解析:此题实质上是0.05mol/L的HAc溶液和0.05mol/L的NaAc溶液的混合溶液。由电荷守恒关系可得:
c(H+)+c(Na+)=c(Ac-)+c(OH-)
(1)
由物料守恒关系可得:
c(HAc)+c(Ac-)=c(Na+)×2=0.01mol/L
(2)
由(2)可知D正确。
将(1)×2+(2)可得: 2c(H+)=c(Ac-)+2c(OH-)-c(HAC)(3)
C选项错误。
例5:用物质的量都是0.1 mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中[CH3COO-]>[Na+],对该混合溶液的下列判断正确的是【 】
A.[H+]>[OH-] B.[CH3COOH]+[CH3COO-]=0.2 mol/L
C.[CH3COOH]>[CH3COO-] D.[CH3COO-]+[OH-]=0.2 mol/L
解析: CH3COOH和CH3COONa的混合溶液中,CH3COOH的电离和CH3COONa的水解因素同时存在。已知[CH3COO-]>[Na+],根据电荷守恒[CH3COO-]+[OH-]=[Na+]+[H+],可得出[OH-]<[H+],说明混合溶液呈酸性,进一步推测出0.1mol/L的CH3COOH和0.1mol/L的CH3COONa溶液中,电离和水解这一对矛盾中起主要作用是电离,即CH3COOH的电离趋势大于CH3COO-的水解趋势。根据物料守恒,可推出(B)是正确的。所以答案为AB
各种类型的典型例题分析
一、关于水的电离的有关叙述:
例1、100℃时纯水电离出的氢离子是25℃纯水电离出的氢离子的多少倍(已知:100℃时Kw=1×10-12;25℃时Kw=1×10-14( )
A 10-2 B 2倍 C 102 D 10倍
练习1:25℃时PH=3的盐酸溶液中由水电离出c(H+)是PH=5的盐酸溶液中由水电离出的c(H+)的多少倍( )
A 103 B 10-2 C 10-3 D 2
练习2:常温下某溶液由水电离出的c(H+)=1×10-11mol/L,则该溶液的PH值可能等于( )
A 11 B 3 C 8 D 7
练习3:25℃时,PH=11的NaOH溶液和NaCN溶液中,由水电离出的c(H+)的关系( )
A 相等 B 后者是前者的11倍 C 后者是前者的108 D前者是后者的108
练习4:将固体苛性钠溶于水配成100mL溶液,当溶液中由水本身电离产生的
c(OH-)=1×10-13mol/l,则加入的苛性钠的质量为( )
A 0.8g B 0.4g C 4g D 40g
练习5:下列四种溶液(1)pH=0的盐酸溶液 (2)0.1mol/L的盐酸溶液 (3)0.01mol/L的NaOH (4)pH=11的NaOH溶液由水电离出的c(H+)浓度之比( )
A 1:10:100:1000 B 0:1:11:11
C 14:13:12:11 D 100;10:1:0
练习6:在由水电离出的c(H+)=10-13mol·L-1的溶液中,一定能大量共存的离子组是( )
A、 K+、Fe2+、 Br-、 NO3- B、 Ba2+、Na+、Cl-、 NO3-
C、 NH4+、Na+、HCO3-、SO42- D、 Na+、Al3+、NO3-、Cl-
二、单一溶质溶液中离子浓度大小关系:
例2、H2S溶液中,各离子浓度大小关系为________________________________________,
例3、Na2S溶液中有哪些微粒?_________________________________________________,
例4、在2mol/L的CH3COONa溶液中,存在哪些平衡?存在哪些守恒关系?
练习7: 在NH4Cl溶液中,离子浓度大小排队正确的是( )
A、c(NH4+)> c(Cl-)> c(OH-)> c(H+) B、c(Cl-)> c(NH4+)> c(OH-)> c(H+)
C、c(Cl-)>c(NH4+)> c(H+)> c(OH-) D、 c(NH4+)> c(Cl-)> c(H+)> c(OH-)
练习8:常温下,下列关于0.1mol/LNH4Cl溶液的说法正确的是( )
①c(NH4+)=0.1mol·L-1 ; ②溶液中 c(H+)· c(OH-)=1.0×10-14 ;
③水电离出来的 c(H+)= c(OH-); ④溶液的pH=1 ;
⑤ c(OH-)= c(NH4+)+ c(H+)- c(Cl-); ⑥升高温度,溶液的pH增大;
⑦加热蒸干溶液,将得不到固体物质; ⑧ c(NH4+)+ c(NH3·H2O)=0.1mol·L-1;
⑨ c(OH-)+ c(NH3·H2O)= c(H+); ⑩ NH4Cl水解的离子方程式为: NH4++OH-== NH3·H2O、
练习9: Na2S溶液中各种离子的物质的量浓度关系不正确的是( )
A、c(Na+)>c(S2-)>c(OH-)>c(HS-) B、c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-)
C、c(Na+)=2c(HS-)+2c(S2-)+2c(H2S) D、c(OH-)=c(H+) + c(HS-)
练习10、在0.1 mol·L-1的NaHCO3溶液中,下列关系式正确的是( )
A、c(Na+)>c(HCO3-)>c(H+)>c(OH-) B、c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-)
C、c(Na+)=c(HCO3-)>c(OH-)>c(H+) D、c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-)
练习11、已知某温度下0.1mol·L-1的NaHB(强电解质)溶液中c(H+)> c(OH-),则下列有关说法或关系式一定正确的是( )
①HB-的水解程度小于HB-的电离程度; ②c(Na+)=0.1mol·L-1 ≥ c(B2-);
③溶液的pH=1; ④ c(Na+)= c(HB-)+2 c(B2-)+ c(OH-)、
A、①② B、②③ C、②④ D、①②③
练习12、已知某酸的酸式盐NaHY的水溶液的pH=8,则下列说法中正确的是( )
A、在Na2Y、NaHY、H2Y的溶液中,阴离子的种类不同
B、NaHY的溶液中,离子浓度大小顺序为:c(Na+)> c(Y-)> c(HY-)> c(OH-)> c(H+)
C、HY-的水解离子方程式为:HY-+H2O![]() Y-+H3O+
Y-+H3O+
D、相同物质的量浓度的Na2Y和NaHY溶液,前者的pH大于后者
三、两种溶液混合后不同离子浓度的比较:
1、两种物质混合不反应:
例4、用物质的量都是0.1 mol的CH3COOH与CH3COONa配成1 L混合溶液,已知其中c(CH3COO-)大于c(Na+),对该混合溶液下列判断正确的是( )
A、c(H+)>c(OH-) B、c(CH3COOH)+c(CH3COO-)=0.2 mol·L-1
C、c(CH3COOH)>c(CH3COO-) D、c(CH3COO-)+c(OH-)=0.1 mol·L-1
练习13、CH3COOH与CH3COONa等物质的量混合配制成稀溶液,pH值为4.7,下列说法错误的( )
A、CH3COOH的电离作用大于CH3COONa的水解作用
B、CH3COOH的存在抑制了CH3COONa的水解
C、CH3COONa的水解作用大于CH3COOH的电离作用
D、CH3COONa的存在抑制了CH3COOH的电离
2、两种物质恰好完全反应:
例5:100 mL 0.1 mol·L-1 醋酸与50 mL 0.2 mol·L-1 NaOH溶液混合,在所得溶液中( )
A、c(Na+)>c(CH3COO-)>c(OH-)>c(H+) B、c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C、c(Na+)>c(CH3COO-)>c(H+)=c(OH-) D、c(Na+)=c(CH3COO-)>c(OH-)>c(H+)
练习14:在甲酸溶液中加入一定量NaOH溶液,恰好完全反应,对于生成的溶液,下列判断一定正确的是( )
A、c(HCOO-)<c(Na+) B、c(HCOO-)>c(Na+)
C、c(OH-)>c(HCOO-) D、c(OH-)<c(HCOO-)
练习15:等体积等浓度的醋酸与NaOH溶液相混合,所得溶液中离子浓度由大到小的顺序是( )
A、c(Na+)>c(Ac-)>c(OH-)>c(H+) B、c(Na+)=c(Ac-)>c(OH-)>c(H+)
C、c(Na+)>c(OH-)>c(Ac-)>c(H+) D、c(Na+)>c(OH-)>c(H+)>c(Ac-)
如果一定量的醋酸和氢氧化钠混合后,溶液的pH=7,则各离子浓度的关系为( )
A、c(Na+)>c(Ac-) B、c(Na+)=c(Ac-)
C、c(Na+)<c(Ac-) D、c(OH-)>c(H+)
3、两种物质反应,其中一种有剩余:
例6、把0.02 mol·L-1 HAc溶液与0.01 mol·L-1NaOH溶液等体积混合,则混合液中微粒浓度关系正确的是( )
A、c(Ac-)>c(Na+) B、c(HAc)>c(Ac-)
C、2c(H+)=c(Ac-)+c(HAc) D、c(HAc)+c(Ac-)=0.01 mol·L-1
例7、将0.2 mol·L-1 CH3COOK 与0.1 mol·L-1盐酸等体积混合后,溶液的pH<7,则溶液中下列微粒的物质的量浓度的关系正确的是( )
A、c(CH3COO-)=c(Cl-)=c(H+)>c(CH3COOH)
B、c(CH3COO-)=c(Cl-)>c(CH3COOH)>c(H+)
C、c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH)
D、c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
练习16:将0.4mol/LNH4Cl溶液和0.2mol/LNaOH溶液等体积混合后,溶液中下列微粒的物质的量关系正确的是( )
A 、c(NH4+)=c(Na+)=c(OH-)>c(NH3·H2O)
B、c(NH4+)=c(Na+)>c(NH3·H2O) >c(OH-)>c(H+)
C、c(NH4+)>c(Na+)>c(OH-)>c(NH3·H2O)
D、c(NH4+)>c(Na+)>c(NH3·H2O) >c(OH-)>c(H+)
4、未指明酸碱的强弱:
例题一元酸HA溶液中,加入一定量强碱MOH溶液后,恰好完全反应,反应后的溶液中,下列判断正确的是( )
A.[A-]≥[M+] B.[A-]≤[M+]
C.若MA不水解,则[OH-]<[A-] D.若MA水解,则[OH-]>[A-]
练习17、实验测得常温下0.1mol/L某一元酸(HA)溶液的pH值等于1, 0.1mol/L某一元碱(BOH)溶液里[H+]/[OH-]=10-12、将此两种溶液等体积混合后,所得溶液呈的各离子的浓度由大到小排列的顺序是( )
A.[B+]>[A-]>[OH-]>[H+] B.[A-]>[B+]>[H+]>[OH-]
C.[B+]=[A-]>[H+]=[OH-] D.[B+]>[A-]>[H+]>[OH-]
5、pH之和等于14的酸和碱溶液的混合:
例:将pH=3的盐酸和pH=11的氨水等体积混合后溶液呈_____性,溶液中c(NH4+)与c(Cl-)的大小关系是___________________;
答案:碱性,c(NH4+)>c(Cl-) ,因为氨水只是少量电离,可见氨水是过量很多,得到的是氯化铵和氨水的混合液,但氨水的量较多
练习18:将pH=3的CH3COOH与pH=11的NaOH溶液等体积混合后,所得的混合溶液中,下列关系式正确的是( )
A、 c(Na+)>c(CH3COO-)>c(H+) >c(OH-) B、 c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C、 c(CH3COO-)>c(H+)>c(Na+)>c(OH-) D、c(CH3COO-)>c(Na+)> c(OH-) >c(H+)
练习19:将pH=2的盐酸与pH=12的氨水等体积混合,在所得的混合溶液中,下列关系式正确的是( )
A、c(Cl-)>c(NH4+)>c(OH-)>c(H+) B、c(NH4+)>c(Cl-)> c(OH-)>c(H+)
C、c(Cl-)=c(NH4+)>c(H+)=c(OH-) D、c(NH4+)>c(Cl-)>c(H+)>c(OH-)
四、不同物质相同离子浓度的比较:
练习物质的量浓度相同的下列溶液①(NH4)2CO3 ②(NH4)2SO4 ③NH4HCO3 ④NH4HSO4⑤NH4Cl ⑥NH3·H2O;按c(NH4+)由小到大的排列顺序正确的是( )
A.③⑤④⑥①③ B.⑥③⑤④①② C.⑥⑤③④①② D.⑥③⑤④②①
高考模拟:
1.某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:
H2A![]() H++HA-,HA-
H++HA-,HA-![]() H++A2-
H++A2-
已知相同浓度时的电离度a(H2A)>a(HA-),设有下列四种溶液:
A. 0.01 mol·L-1的H2A溶液
B. 0.01 mol·L-1的NaHA溶液
C. 0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合液
D. 0.02 mol·L-1的NaOH与0.02 mol·L-1的NaHA溶液等体积混合液
据此,填写下列空白(填代号):
(1) c(H+)最大的是 ,最小的是 。
(2) c(H2A)最大的是 ,最小的是 。
(3) c(A2-)最大的是 ,最小的是 。
答. (1) A;D (2) C;D (3) D;A