高二化学电离平衡练习
第一、二节 电离平衡、水的电离和溶液的pH小测
一、选择题(每小题只有一个正确答案)
1. 下列物质中属于电解质的是( )
A.干冰 B.氯水 C.铜 D. 氯化氢
2. 下列物质能导电的是( )
①固体食盐 ②溴水 ③CuSO4·5H2O ④液溴 ⑤蔗糖 ⑥氯化氢气体
⑦盐酸 ⑧液态氯化氢
A.①④⑤ B.②⑦ C.⑤⑥⑧ D.④⑧
3. 下列物质的水溶液能导电,但属于非电解质的是( )
A.CH3COOH B.Cl2 C.NH4HCO3 D.SO2
4. 下列事实可证明氨水是弱碱的是 ( )
A.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁 B.铵盐受热易分解
C. 0.1mol/L的氨水pH<13 D. 0.1mol/L氨水可以使酚酞试液变红
5. 下列叙述中正确的是( )
A.Ca(OH)2微溶于水, 所以是弱电解质
B.在水中能电离出离子的化合物一定是离子化合物
C.CO2分子中含极性键, 且溶于水能导电, 所以CO2是电解质
D.NH3·H2O在水中只能部分电离, 所以是弱电解质
6. 在pH=1的无色透明溶液中,不能大量共存的离子组是( )
A.Al3+ Ba2+ NO3- Cl- B.Mg2+ NH4+ NO3- Cl-
C.Fe2+ K+ S2- Cl- D.Zn2+ Na+ NO3- SO42-
7. 下列有关溶液性质的叙述,正确的是
A.室温时饱和的二氧化碳水溶液,冷却到0℃时会放出二氧化碳气体
B.20℃,100 g水中可溶解34.2 g KCl,此时KCl饱和溶液的质量分数为34.2%
C.强电解质在水中溶解度一定大于弱电解质
D.相同温度下,把水面上的空气换成相同压力的纯氧,100g水中溶入氧气的质量增加
8. 下列溶液一定呈中性的是( )
A.将pH=5的盐酸稀释100倍所得溶液
B.c(H+)=c(OH-) =1×10-6mol/L的溶液
C.由强酸、强碱等物质的量反应得到的溶液
D.非电解质溶于水得到的溶液
9. 下列各种试纸,使用时预先不能用蒸馏水润湿的是 ( )
A.红色石蕊试纸 B.淀粉KI试纸 C.醋酸铅试纸 D.PH试纸
10. 下列液体pH>7的是 ( )
A.人体血液 B.蔗糖溶液 C..橙汁 D.胃液
11. 纯水在25℃和80℃时的氢离子浓度,前者和后者的关系是( )
A.前者大 B.相等 C.前者小 D.不能肯定
12. 下列说法中正确的是( )
A.在25℃纯水中,c(H+) = c(OH-) = 10-7 mol/L,呈中性
B.溶液中,若c(H+) > 10-7 mol/L,则c(H+) > c(OH-),呈酸性
C.c(H+)越大,则pH越大,溶液的碱性越强
D.pH为0的溶液,其中只有H+而无OH-
13. 下列四种溶液中,由水电离生成的氢离子浓度之比(①∶②∶③)是( )
① pH = 0的盐酸 ② 0.1 mol/L的盐酸 ③ 0.01 mol/L的NaOH溶液
A.1∶10∶100 B.0∶1∶12
C.14∶13∶12 D.14∶13∶2
14. ![]() 与纯水的电离相似,液氨中存在着微弱的电离:2NH3 NH4+ + NH2- , 据此判断以下叙述错误的是 ( )
与纯水的电离相似,液氨中存在着微弱的电离:2NH3 NH4+ + NH2- , 据此判断以下叙述错误的是 ( )
A.液氨中含有NH3、NH4+、NH2_ 等粒子
B.一定温度下,液氨中c (NH4+) · c (NH2-) 是一个常数
C.液氨的电离达到平衡时,c (NH3) = c(NH4+) = c (NH2_)
D.只要不加入其他物质,液氨中c (NH4+) = c (NH2_)
15. 将0.l mol/L醋酸溶液加水稀释,下列说法正确的是 ( )
A.溶液中c(H+)和c(OH-)都减小 B.溶液中c(H+)增大
C.醋酸电离平衡向左移动 D.溶液的pH增大
16. 在溶液导电性实验装置里,分别注入20 mL 4 mol/L的醋酸和20 mL 4 mol/L的氨水,灯光明暗程度相似,如果把这两种溶液混合后再试验,则
A.灯光明暗程度不变 B.灯光变暗
C.灯光变亮 D.灯光明暗程度变化不明显
17. 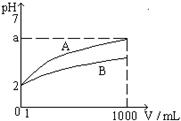 pH=2的A、B两种酸溶液各1mL, 分别加水稀释到
pH=2的A、B两种酸溶液各1mL, 分别加水稀释到
1000mL,其溶液的pH与溶液体积(V)的关系如右图所
示, 则下列说法正确的是 ( )
A.A、B两种酸溶液物质的量浓度一定相等
B.稀释后A酸溶液的酸性比B酸溶液强
C.a = 5时, A是弱酸, B是强酸
D.若A、B都是弱酸, 则5 > a > 2
18. pH=12的NaOH溶液和pH=10的NaOH溶液等体积混和后溶液的 ( )
A.pH=11 B.pH=10.3
C.c(H+)=2×10-12mol/L D.c(H+)=5×10-11mol/L
19. 若1体积硫酸恰好与10体积pH=11的氢氧化钠溶液完全反应,则二者物质的量浓度之比应为 ( )
A.10:1 B.5:1 C.1:1 D.1:10
20. 有人曾建议用AG表示溶液的酸度,AG的定义为AG=lg{c(H+)/c(OH-)}。
下列表述正确的是 ( )
A.在25 ℃时,若溶液呈中性,则pH=7,AG=1
B.在25 ℃时,若溶液呈酸性,则pH<7,AG<0
C.在25 ℃时,若溶液呈碱性,则pH>7,AG>0
D.在25 ℃时,溶液的pH与AG的换算公式为AG=2 ( 7-pH)
二、非选择题
21. 现有以下物质: ①硫酸铜 ②碳酸钙固体 ③磷酸 ④硫化氢 ⑤乙醇 ⑥食盐水 ⑦石墨 ⑧苛性钾 ⑨NH3·H2O ⑩熟石灰。其中(填序号):
(1)属于强电解质的是 ;
(2)属于弱电解质的是 ;
(3)属于非电解质的是 ;
(4)既不是电解质,也不是非电解质的是 。
22. 写出下列物质溶于水的电离方程式或反应的离子方程式
(1)硫化氢 ;
(2)Fe(OH)3 ;
(3)NaHCO3 ;
(4)KAl(SO4)2 ;
(5)KHSO4 ;
(6)Ba(OH)2 ;
(7)硫酸与氨水反应 ;
(8)醋酸钠溶液与盐酸反应 ;
(9)碳酸钡与醋酸反应 ;
(10)NaHCO3与足量Ba(OH)2反应 。
23. 用化学式或离子符号表示:
氯水中含有的分子有 离子有 ; 氨水中含有的分子有 离子有 。
24. 在0.1mol/mol的氨水溶液中,存在如下电离平衡:NH3+H2O ![]() NH4++OH-(正反应为吸热反应)。在此平衡体系中,若按下列情况变动,请将变化情况[增大用“↑”,减小用“↓”向左用“←”,向右用“→”]填入表中。
NH4++OH-(正反应为吸热反应)。在此平衡体系中,若按下列情况变动,请将变化情况[增大用“↑”,减小用“↓”向左用“←”,向右用“→”]填入表中。
| 条件的变化 | 升温 | 通氨气 | 加水 | 加NaOH(固) | 加NH4Cl(固) | 通CO2 |
| 电离平衡移动的方向 | ||||||
| n(OH-) | ||||||
| c(OH-) | ||||||
| c(NH3·H2O) | ||||||
| 导电能力 |
25.中和相同体积,相同pH的Ba(OH)2、NaOH、和NH3·H2O三种稀溶液所用相同浓度的盐酸的体积分别为V1、V2、V3 ,则三者关系为 。
26..今有a.盐酸 b.硫酸 c.醋酸三种酸:
(1)在同体积,同pH的三种酸中,分别加入足量的碳酸钠粉末, 在相同条件下产生
CO2的体积由大到小的顺序是_________________。(填酸的序号,下同)。
˙˙˙
(2)在同体积、同浓度的三种酸中,分别加入足量的碳酸钠粉末,在相同条件下产生CO2的体积由大到小的顺序是_________________。
˙˙˙
(3)物质的量浓度为0.1 mol/L的三种酸溶液的pH由大到小的顺序是___________;如 ˙˙˙
果取等体积的0.1 mol/L的三种酸溶液,用0.1 mol/L的NaOH溶液中和,当恰好完全反应时,消耗NaOH溶液的体积由大到小的顺序是______________。
˙˙˙
27.有两瓶pH=2的酸溶液,一瓶是强酸,一瓶是弱酸。现只有石蕊试液、酚酞试液、pH试纸和蒸馏水。简述如何用最简便的实验方法来判断哪瓶是强酸。
。
28.25℃时,若体积为V a ,pH=a的某一元强酸与体积为Vb ,pH = b的某一元强碱混合,恰好中和,且已知V a <Vb和a = 0.5b,请填写下列空白;
(1)a值可否等于3(填“可”或“否”)_________,其理由是________________
。
(2)a值可否等于5(填“可”或“否”)________,其理由是____________________
。
(3)a的取值范围是______________________________________ 。
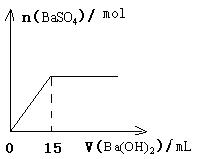 29.在20mL由HNO3和H2SO4组成的混合溶液中,逐滴加入4mol/L Ba(OH)2溶液,结果如下图所示,求原溶液中HNO3和H2SO4的物质的量浓度分别是多少?
29.在20mL由HNO3和H2SO4组成的混合溶液中,逐滴加入4mol/L Ba(OH)2溶液,结果如下图所示,求原溶液中HNO3和H2SO4的物质的量浓度分别是多少?
 |
第一、二节 电离平衡、水的电离和溶液的pH答案
一、选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | D | B | D | C | D | C | D | B | D | A |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | C | A | A | C | D | C | D | C | B | D |
二.非选择题
21.(1) ① ② ⑧ ⑩; (2) ③ ④ ⑨; (3) ⑤; (4) ⑥ ⑦。
22.(1) H2S ![]() H++HS- ; HS-
H++HS- ; HS- ![]() H+ + S2- 。
H+ + S2- 。
(2) Fe(OH)3 ![]() Fe3+
+ 3OH-
Fe3+
+ 3OH-
(3) NaHCO3 ═ Na++HCO3- ; HCO3-
![]() H++CO3-
。
H++CO3-
。
(4) KAl(SO4)2 ═ K+ + Al3+ + 2SO42- 。
(5) KHSO4 ═ K++H++SO42-。
(6) Ba(OH)2 ═ Ba2+ + 2OH - 。
(7) H++NH3·H2O ═ NH4++H2O 。
(8) CH3COO-+H+═ CH3COOH
(9) BaCO3 + 2CH3COOH ═ Ba2+ + 2 CH3COO- + CO2 ↑+ H2O
(10)HCO3_ +Ba2++OH - = BaCO3↓+ H2O
23.Cl2 、HClO、H2O, Cl- 、ClO-、H+、OH- ;
NH3 、NH3·H2O 、H2O , NH4+、OH-、 H+。
24.
| 条件的变化 | 升温 | 通氨气 | 加水 | 加NaOH(固) | 加NH4Cl(固) | 通CO2 |
| 电离平衡移动方向 | → | → | → | ← | ← | → |
| n(OH-) | ↑ | ↑ | ↑ | ↑ | ↓ | ↓ |
| c (OH-) | ↑ | ↑ | ↓ | ↑ | ↓ | ↓ |
| c(NH3·H2O) | ↓ | ↑ | ↓ | ↑ | ↑ | ↓ |
| 导电能力 | ↑ | ↑ | ↓ | ↑ | ↑ | ↑ |
25.V3﹥V2 = V1 。
26.(1)c>a=b ,(2)b>a=c , (3)c>a>b , b>a=c 。
27. 各取等体积溶液用蒸馏水分别稀释100倍,然后用PH试纸分别测其PH,PH变化大的那瓶是强酸。
28.(1) 否,若a=3,则b=6,溶液显酸性,与题意不符,故a≠3 。
(2)否,若a=5,c(H+)a=10-5mol/L,则b=10,c(OH-)b = 10-4mol/L ,
Va / Vb=c(OH-)b / c(H+)a > 1 , 不符合题意,故a≠5 。
(3)7/2<a<14/3 。
29.c(HNO3)=2 mol/L , c(H2SO4)= 3 mol/L 。