高二年级化学上学期期末质量检查
理科化学试卷
(试卷满分:100分;考试时间:90分钟)
第I卷(选择题,共48分)
可能用到的相对原子质量:H-1 O-16 Al-27
一、选择题(本题有16小题,每小题3分,共48分。每小题只有一个选项符合题意。)
1.下列说法中正确的是:
A. 氮族元素气态氢化物稳定性由上至下逐渐增强
B. 氮气可作焊接金属的保护气
C. 雷雨时发生的化学变化属于生物固氮
D. 二氧化氮溶于水生成硝酸,因此二氧化氮是硝酸的酸酐
2.下列化学用语表达正确的是
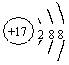
A.S2—的结构示意图: B.乙炔的结构式:C2H2
![]()
![]() C.
C.![]() 的电子式: D.硝基苯的结构简式:
的电子式: D.硝基苯的结构简式:
3. 1mol某烃完全燃烧,生成3mol ![]() 和2mol
和2mol ![]() ,此烃是
,此烃是
A. ![]() B.
B. ![]() C.
C.
![]() D.
D.
![]()
4. 常温时下列物质的水溶液,其pH小于7的是
A.Na2CO3 B.(NH4)2SO4 C.KNO3 D.Na2SO4
5.在一定温度下,可逆反应X(g)+3Y(g) ![]() 2Z(g)达到平衡的标志是
2Z(g)达到平衡的标志是
A.Z生成的速率与Z分解的速率相等 B.单位时间生成n mol X,同时生成3 n mol Y
C.v正(X)=3v逆(Y) D.X、Y、Z的分子数比为1:3:2
6 .钢铁发生腐蚀时,负极上发生的反应为
A.2H2O+O2+4e-=4OH- B.2Fe2++4e-=2Fe
C. Fe-2e-=Fe2+ D.Fe3++e-=Fe2+
7.硝酸应避光保存是因为它具有
A.强酸性 B.强氧化性 C.挥发性 D.不稳定性
8 .下列反应达到平衡后,增大压强或升高温度,平衡都向正反应方向移动的是
A.2NO2(g) ![]() N2O4(g)(正反应为放热反应)
N2O4(g)(正反应为放热反应)
B.3O2(g) ![]() 2O3(g)(正反应为吸热反应)
2O3(g)(正反应为吸热反应)
C.H2(g)+I2(g) ![]() 2HI(g)(正反应为放热反应)
2HI(g)(正反应为放热反应)
D.NH4HCO3(s) ![]() NH3(g)+H2O(g)+CO2(g)(正反应为吸热反应)
NH3(g)+H2O(g)+CO2(g)(正反应为吸热反应)
9.有NaCl、MgCl2、NH4Cl、AlCl3、FeCl2五种溶液,只用一种试剂即可把它们鉴别出来,这种试剂可以是下列的
A.浓硫酸 B.AgNO3溶液 C.NaOH溶液 D.KSCN溶液
10.下列各组离子中,能在水溶液中大量共存的是
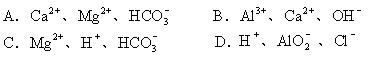
11.能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的操作是
A.往纯水中加入碳酸钠固体 B.将水加热煮沸
C.向水中通入二氧化氮气体 D.往水中加食盐晶体
12.一个甲基(-CH3)取代菲( )分子中一个氢原子,所得的同分异构体数目为
A.4 B.5 C.10 D.20
13.下列除去杂质的操作方法正确的是:
A. NO中有少量的NO2:用水洗涤后再干燥
B. 食盐中有少量的NH4Cl:加过量的烧碱溶液后加热蒸干
C. N2中有少量的O2:通过灼热的氧化铜
D. 红磷中有少量的白磷:加热到40℃,使白磷自燃
14.某炔烃氢化后得到的饱和烃如下:CH3-![]() CH2-CH2-
CH2-CH2-![]() CH3,该炔烃可能的结构有
CH3,该炔烃可能的结构有
A. 1种 B. 2种 C. 3种 D. 4种
15.将10mL、0.1mol/L氨水与10mL 0.1mol/L盐酸混合后,溶液中各种离子的物质的量浓度由大到小的顺序是
A. c(Cl-)>c(NH![]() )>c(OH-)>c(H+) B. c(Cl-)>c(NH
)>c(OH-)>c(H+) B. c(Cl-)>c(NH![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
C. c(H+)>c(OH-) >c(Cl-)>c(NH![]() )
D. c(H+)>c(Cl-) >c(NH
)
D. c(H+)>c(Cl-) >c(NH![]() )>c(OH-)
)>c(OH-)
16.下列各项中的两个量,其比值一定为2 : 1的是
A.在反应2FeCl3+Fe=3FeCl2中,氧化剂与还原剂的物质的量
B.相同温度下,0.2mol·L-1CH3COOH溶液中c(H+)与0.1mol·L-1CH3COOH溶液中c(H+)
![]() C.在密闭容器中,反应N2(g)+3H2(g)
2NH3(g)已达平衡时的c(NH3)与c(N2)
C.在密闭容器中,反应N2(g)+3H2(g)
2NH3(g)已达平衡时的c(NH3)与c(N2)
D.液面均在“0”刻度时,50mL碱式滴定管和25mL碱式滴定管所盛溶液体积
第II卷(非选择题,共52分)
二、填空题(本题有4小题,共34分)
17.Ⅰ.(4分)下列四组物质中, 互为同位素;
是同素异形体;
是同分异构体;
是同系物。(填数字序号)
① O2和O3 ② 35Cl 和37Cl ③ CH3CH3和CH3CH2CH2CH3
④CH3CH2CH2CH(CH3)CH2CH3 和 CH3CH2CH(CH3)CH(CH3)CH3
Ⅱ. (8分)已知 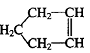 可简写为
可简写为  ,降冰片烯的分子结构可表示为:
,降冰片烯的分子结构可表示为: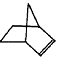
(1)降冰片烯属于__________。
a.苯的同系物 b.不饱和烃 c.烷烃 d.芳香烃
(2)降冰片烯的分子式为__________。
(3)降冰片烯具有的性质为__________。
a.能溶于水 b.能发生氧化反应 c.能发生加成反应 d.常温常压下为气体
(4)降冰片烯与等物质的量的H2加成,写出该加成产物的任意一种同分异构体(要求该同分异构体为含有3个甲基的炔烃)的结构简式为______________。
18 .(8分)提示:某些金属氧化物跟熔融烧碱反应可生成盐。根据以下化学反应框图填空:
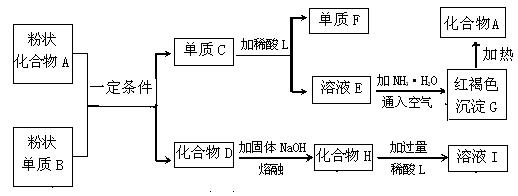
(1)单质F是________________。
(2)写出A与B反应的化学方程式:___________________________________。
(3)溶液I中所含金属离子是___________、____________。
(4)写出溶液E中通入Cl2反应的离子方程式:_________________________。
19 .Ⅰ.(6分)反应m A+n B![]() p C在某温度下达到平衡。
p C在某温度下达到平衡。
(1)若A、B、C都是气体,增大压强化学平衡向右移动,则m、n、p的关系是________________ 。
(2)若C为气体,且m + n = p,在加压时化学平衡发生移动,则平衡必定向______方向移动。
(3)如果在体系中只增加或减少B的量,平衡均不发生移动,则B肯定不能为_____态。
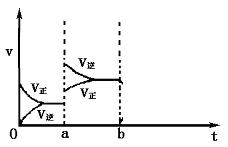
Ⅱ.(4分)下图表示密闭容器中:2SO2(g)+O2(g)![]() 2SO3(g)(放热反应)在达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,则a时刻改变的条件可能是
; 若在b时刻增大压强,一段时间后达到平衡,请在下图相应位置画出该反应速率变化情况。
2SO3(g)(放热反应)在达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,则a时刻改变的条件可能是
; 若在b时刻增大压强,一段时间后达到平衡,请在下图相应位置画出该反应速率变化情况。
20.(4分)今有①CH3COOH、②HCl、③H2SO4三种溶液,用序号回答下列问题
(1)当它们pH和体积相同时,与Fe反应的平均速率最快的是 。
(2)当它们物质的量浓度相同时,其pH最小的是 。
(3) 当它们的体积均为100 mL、pH均为4时,均加水900 mL稀释,则稀释后溶液的pH最小是 。
(4)当它们的pH和体积相同时,中和同浓度的NaOH所需NaOH溶液的体积最大是 。
三、实验题(本题有1小题, 共10分)
21 .(10分)以下是测定盐酸物质的量浓度的实验:① 首先用NaOH固体配制0.10mol·L-1
NaOH溶液1L;②将待测盐酸稀释10倍; ③取稀释后的盐酸10.00mL放入锥形瓶中;④滴入指示剂;⑤用 NaOH 标准溶液进行滴定;⑥滴定重复进行3次,求出滴定中所用标准溶液体积的平均值。根据以上操作,回答下列问题:
⑴从下列选项中选出①、③操作中各需要的任意一种仪器,用序号回答:
a. 胶头滴管 b.容量瓶 c.碱式滴定管 d.酸式滴定管 e.烧杯 f.烧瓶
①_________、③__________;
⑵该实验选用的指示剂最不适合的是_______;
A.甲基橙(3.1~4.4) B.酚酞(8~10) C.石蕊(5~8)
⑶如果碱式滴定管用水洗净后,未用标准溶液润洗,则 HCl 的物质的量浓度________(填“偏高”、“偏低”或“无影响”,下同),如果碱式滴定管读数时滴定前仰视滴定后俯视,则测定结果 HCl 的物质的量浓度_________。
⑷设⑥中的平均值为7.50mL,则未稀释时盐酸的物质的量浓度为___________mol/L;
四、计算题(本题有1小题, 共8分)
22.(8分)在100mL bmol/L的AlCl3溶液中加入等体积a mol/L的NaOH溶液。
(1)当a、b满足 条件时无沉淀生成。
(2)当a≤3b时,生成Al(OH)3的物质的量为 。(用a或b的代数式表示)
(3)当a=0.2, b=0.1 时生成Al(OH)3的质量为多少?(该小题写出必要的计算过程)
高二年级化学上学期期末质量检查
理科化学科答案
第I卷(选择题,共48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | B | D | A | B | A | C | D | B |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | C | A | C | B | A | A | B | A |
第II卷(非选择题,共52分)
二、填空题
17.Ⅰ.(每空1分) ②;①;④;③
Ⅱ.(每空2分) ⑴b ⑵ C7H10 ⑶ b、c
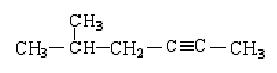
(4) (其他合理答案也可)
18.(每空2分)(1) H2
(2)2Al+Fe2O3![]() Al2O3+
2Fe
Al2O3+
2Fe
(3)Na+、Al3+
(4) 2Fe2+ + Cl2 == 2Fe3+ + 2Cl-
19. Ⅰ(每空2分) (1)m+n>p (2)左(或逆反应)(3)气
Ⅱ(每空2分)升高温度(其他合理答案也可);
20.(每空1分)⑴① ⑵③ ⑶① (4) ①
21.⑴①a(或b、e )(1分) ③d (1分) ⑵C (2分)
⑶偏高;偏低(每空2分) (4)0.75(2分)
22.⑴a≥4b (2分)
⑵0.1a/3 mol (2分)
⑶0.52 g(4分)