高二上学期级期末考试化学科试题
注意:本试卷分选择题和非选择题两部分,满分150分,考试用时120分钟;必须将所有答案填写在答题卷上,考试结束后只上交答题卷。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Al 27 S 32 Cl 35.5
第一部分 选择题(共80分)
一、选择题(本题包括10小题,每小题4分,共40分。每小题只有一个选项符合题意)
1.已知溶液中存在Cr2O72- + H2O![]() 2CrO42- + 2H+的平衡,其中Cr2O72-呈橙色,CrO42-呈黄色,向该平衡体系中滴加饱和NaOH溶液时,颜色的变化情况是( )
2CrO42- + 2H+的平衡,其中Cr2O72-呈橙色,CrO42-呈黄色,向该平衡体系中滴加饱和NaOH溶液时,颜色的变化情况是( )
A.橙色加深 B.黄色加深 C.颜色不变 D.颜色褪去
2.下列反应中生成物总能量高于反应物总能量的是( )
A.碳酸钙受热分解 B.乙醇燃烧
C.铝粉与氧化铁粉末反应 D.氧化钙溶于水
3.已知2NO(g) + O2(g)![]() 2NO2(g)的平衡常数为K1,2NO2(g)
2NO2(g)的平衡常数为K1,2NO2(g)![]() N2O4(g)的平衡常数为K2,则反应2NO(g) + O2(g)
N2O4(g)的平衡常数为K2,则反应2NO(g) + O2(g)![]() N2O4(g)的平衡常数K是( )
N2O4(g)的平衡常数K是( )
A.K1+K2 B.K1/K2 C.K1×K2 D.K1-K2
4.已知热化学方程式:SO2(g)+ O2(g)![]() SO3(g) △H=―98.32kJ/mol,在容器中充入2molSO2 和1molO2充分反应,最终放出的热量为( )
SO3(g) △H=―98.32kJ/mol,在容器中充入2molSO2 和1molO2充分反应,最终放出的热量为( )
A.196.64kJ B.196.64kJ/mol C.<196.64kJ D.>196.64kJ
5.在已经处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明平衡移动的是
A.反应混合物的浓度 B.反应物的转化率
C.正、逆反应速率 D.反应混合物的压强
6.在一个密闭烧瓶中,在25℃时存在着平衡:2NO2![]() N2O4
△H<0,如把烧瓶置于100℃的沸水中,则下列几项性质中:①颜色 ②平均分子量 ③质量 ④压强 ⑤密度,其中不会改变的是( )
N2O4
△H<0,如把烧瓶置于100℃的沸水中,则下列几项性质中:①颜色 ②平均分子量 ③质量 ④压强 ⑤密度,其中不会改变的是( )
A.①和③ B.③和⑤ C.④和⑤ D.②和④
7.在密闭容器中,有可逆反应:nA(g)+mB(g)![]() pC(g) △H>0处于平衡状态(已知m+n>p),下列说法中①升高温度时,c(B)/c(C)的值减小;②降温时,体系内混合气体的平均分子质量减小;③加入B后,A的转化率变大;④加入催化剂,气体总物质的量不变;⑤充入C后,A,B的物质的量增大。其中正确的是( )
pC(g) △H>0处于平衡状态(已知m+n>p),下列说法中①升高温度时,c(B)/c(C)的值减小;②降温时,体系内混合气体的平均分子质量减小;③加入B后,A的转化率变大;④加入催化剂,气体总物质的量不变;⑤充入C后,A,B的物质的量增大。其中正确的是( )
A.③④ B.②③⑤ C.①②⑤ D.全部
8.下列叙述正确的是( )
A.单体的质量之和等于所生成高聚物的质量
B.单体为一种物质时,则单体发生加聚反应
C.缩聚反应的单体至少有两种物质
D.淀粉和纤维素的链节都是C6H10O5,但聚合度不同,彼此不是同分异构体
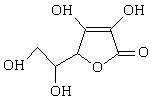 9.2006年3月2日英国《泰晤士报》报道指出:汽水中如果同时含有苯甲酸钠(防腐剂,C6H5COONa)与维生素C(抗氧化剂,结构式如右图所示)可能会相互作用生成苯。下列说法不正确的是( )
9.2006年3月2日英国《泰晤士报》报道指出:汽水中如果同时含有苯甲酸钠(防腐剂,C6H5COONa)与维生素C(抗氧化剂,结构式如右图所示)可能会相互作用生成苯。下列说法不正确的是( )
A.苯是平面型的分子
B.苯在一定条件下能发生取代反应和加成反应
C.维生素C能在碱性溶液中稳定存在
D.维生素C可溶解于水
10.下列叙述不正确的是( )
A.淀粉、纤维素、油脂都属于高分子化合物 B.能发生酯化反应的酸不一定都是羧酸
C.天然蛋白质水解的最终产物均为氨基酸 D.油脂水解得到的醇是丙三醇
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
11.在一定温度下的定容密闭容器中,当下列物理量不再发生变化时,表明反应A(s)+2B(g)![]() C(g)+D(g)已达平衡状态的是( )
C(g)+D(g)已达平衡状态的是( )
A.混合气体的压强 B.混合气体的密度
C.B的物质的量浓度 D.气体总物质的量
12.在气相条件下(T=500 K),有相同体积的甲、乙两容器,甲容器充人1 g SO2、l gO2,乙容器充人2 g SO2、2g O2则下列叙述中正确的是( )
A.化学反应速率:乙>甲 B.平衡后SO2的浓度:乙>甲
C.SO2转化率:乙<甲 D.平衡后O2的体积分数:乙>甲
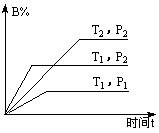 13.mA(g)+nB(g)
13.mA(g)+nB(g)![]() qC(g)反应在密闭容器中进行,如图表示反应过程中温度T,压强P与B%(气体B在混合气体中的百分含量)的关系曲线由曲线分析,下列结论正确的是( )
qC(g)反应在密闭容器中进行,如图表示反应过程中温度T,压强P与B%(气体B在混合气体中的百分含量)的关系曲线由曲线分析,下列结论正确的是( )
A.m+n>q 正反应为放热反应 B.m+n>q 正反应为吸热反应
C.m+n<q正反应为放热反应 D.m+n<q 正反应为吸热反应
14.某温度下,在固定容积的容器中,可逆反应A(g)+3B(g)![]() 2C(g)达到平衡,此时测得n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的是
2C(g)达到平衡,此时测得n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的是
A.刚充入时反应速率υ正减少,υ逆增大 B.平衡不发生移动
C.平衡向逆反应方向移动 D.物质C的质量分数增大
15.已知化学反应2C(s)+O2(g)![]() 2CO(g);2CO(g) + O2(g)
2CO(g);2CO(g) + O2(g)![]() 2CO2(g)都是放热反应。据此推断,下列说法不正确的是(相同条件下)( )
2CO2(g)都是放热反应。据此推断,下列说法不正确的是(相同条件下)( )
A.56gCO和32gO2所具有的总能量大于88gCO2所具有的总能量
B.12gC所具有的能量一定高于28gCO所具有的能量
C.12gC和32gO2所具有的总能量大于44gCO2所具有的总能量
D.将两份碳燃烧,生成CO2的反应比生成CO的反应放出的热量多
16.已知两个热化学方程式:C(s)+O2(g)=CO2(g) △H=-393.5kJ/mo; 2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol,现有炭粉和H2组成的悬浮气共0.2mol,使其在O2中完全燃烧,共放出63.53kJ的热量,则炭粉与H2的物质的量之比是( )
A.1︰1 B.1︰2 C.2︰3 D.3︰2
17.在一密闭容器中,反应aA(g)![]() bB(g)达平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时B的浓度是原来的60%,则( )
bB(g)达平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时B的浓度是原来的60%,则( )
A.平衡向正反应方向移动了 B.物质A的转化率减小了
C.物质B的体积分数增加了 D.a>b
18.能够鉴定溴乙烷中溴元素的存在的最佳操作是( )
A.在氯乙烷中直接加入AgNO3溶液
B.加蒸馏水,充分搅拌后,加入AgNO3溶液
C.加入NaOH溶液,加热后加入稀硝酸酸化,然后加入AgNO3溶液
D.加入NaOH的乙醇溶液,加热后加入AgNO3溶液
19.实验室用溴和苯反应制取溴苯,得到粗溴苯后,要用如下操作精制:①蒸馏 ②水洗 ③用干燥剂干燥 ④10%NaOH溶液洗 ⑤水洗,正确的操作顺序是( )
A.①②③④⑤ B.②④⑤③①
C.④②③①⑤ D.②④①⑤③
20.用饱和NaHCO3溶液能把括号内杂质除去的是( )
A.CO2(HCl) B.C6H6(C6H5OH)
C.CH3COOC2H5(CH3COOH) D.HCOOH(HCOONa)
第二部分 非选择题(共70分)
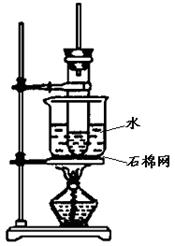 三、(本题包括2小题,共20分)
三、(本题包括2小题,共20分)
21.(10分)如下图是实验室制取酚醛树脂的装置图。
(1)装置中的一处错误是_____________________________。
(2)试管上方长玻璃管的作用是_______________________。
(3)该实验不须使用温度计的原因是___________________。
(4)水浴加热的特点是_______________________________。
(5)实验完毕后,若试管用水不易洗涤,可以加入少量_______浸泡几分钟,然后洗净。
(6)写出实验室制取酚醛树脂的化学方程式_________________,
此有机反应类型是_____________________。
22.(10分)在一次学生实验中,学生用铝片分别和稀盐酸、稀硫酸反应,发现:铝片与稀盐酸反应现象非常明显,而和稀硫酸几乎不反应。这和教材中“铝能跟稀盐酸或稀硫酸反应生成氢气“的说法不一致。已排除因试剂变质等因素造成的影响,该学生在教师的指导下重新进行下列实验,验证是否存在上述现象。
实验用品:仪器(略,凡是实验需要的都有)
药品:3.0mol/L盐酸、1.5mol/L硫酸、3.0mol/L硫酸,相同大小的铝片(纯度>99.5%)
实验过程:往三支相同的试管中分别加入相同的铝片各一片,再往试管中分别加入等体积的3.0mol/L盐酸、1.5mol/L硫酸、3.0mol/L硫酸,观察反应进行到1、2、5、15、20分钟时的铝与酸反应的情况。结果如下:
| 反应进程(分钟) | 1 | 2 | 5 | 15 | 20 |
| 3.0mol/L盐酸 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
| 1.5mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
| 3.0mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
通过上述实验可知,无论是用1.5mol/L硫酸还是3.0mol/L硫酸,均无明显的现象,而3.0mol/L盐酸与铝片反应的现象却十分明显。
(1)写出铝与酸反应的离子方程式______________________________________________
(2)反应1~15min内,铝与盐酸的反应速率逐渐加快,其原因是_______________________
________________________________________________________________________________。
(3)同学们在探究0.01mol/L KMnO4溶液与0.2mol/L H2C2O4溶液发生反应2KMnO4 + 5H2C2O4 + 3H2SO4 = K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O时发现,反应前阶段KMnO4溶液褪色速率非常缓慢,但后阶段的褪色速率却非常快,同学们分析后阶段褪色速率却非常快是因为某物质对上述反应起了______作用,该物质可能是_________。
(4)受上述探究实验的启发,同学们顺利提出了“铝与稀盐酸和稀硫酸反应差异的原因”。你能对该问题原因做出某些假设或猜想吗?(列出两种即可,Al3+的影响已经排除)
假设一:________________________________________________________________________;
假设二:________________________________________________________________________;
如何设计实验验证你的假设,请简述你设计的实验的要点:
_______________________________________________________________________________。
四、(本题包括3小题,共30分)
23.(9分)某温度下SO2的转化反应的平衡常数K =532.4
2SO2+O2 ![]() 2SO3
2SO3
下面三个混合体系中各物质的浓度如下表:
| 体系 | c(SO2) mol/L | c(O2) mol/L | c(SO3) mol/L | 反应方向 |
| (1) | 0.0600 | 0.400 | 2.000 | |
| (2) | 0.0960 | 0.300 | 0.500 | |
| (3) | 0.0862 | 0.263 | 1.020 |
试判断各体系中反应进行的方向:
体系(1) ;
体系(2) ;
体系(3) 。
24.(10分)在一个盛有催化剂的容积可变的密闭容器中,保持一定温度和压强,进行以下反应,N2(气)+3H2(气)![]() 2NH3(气),已知加入1mol N2和4molH2时,达到平衡后生成amolNH3,在相同条件下,且保持平衡时各组分的百分含量不变,填写表中空白:
2NH3(气),已知加入1mol N2和4molH2时,达到平衡后生成amolNH3,在相同条件下,且保持平衡时各组分的百分含量不变,填写表中空白:
| 编号 | 起始物质的量(mol) | 平衡时NH3的物质的量(mol) | ||
| N2 | H2 | NH3 | ||
| 已知 | 1 | 4 | 0 | a |
| (1) | 1.5 | 6 | 0 | |
| (2) | 1 | 0.5a | ||
| (3) | m | n(n≥4m) | ||
25.(11分)如图所示,当关闭K时,向A中充入2molX、7molY,向B中充入4molX、14molY,起始时VA=VB=a升,在相同温度和有催化剂存在的条件下,两容器各自发生下列反应:2X(g)+2Y(g)![]() Z(g)+2W(g)△H<0,达到平衡(Ⅰ)时V(B)=0.9a升,试回答:
Z(g)+2W(g)△H<0,达到平衡(Ⅰ)时V(B)=0.9a升,试回答:
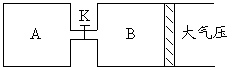 (1)B中X 的转化率α(X)B为__________。
(1)B中X 的转化率α(X)B为__________。
(2)A中W和B中Z的物质的量的比较:
n(W)A ______ n(Z)B (填<、>、或=)
(3)打开K,过一段时间重新达平衡(Ⅱ)时,B的体积为_______升(用含a的代数式表示,连通管中气体体积不计)
(4)要使B容器恢复原来反应前的体积,可采取的措施是_________________。
五、(本题包括2小题,共20分)
26.(10分)柠檬酸结构简式如下:
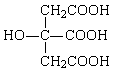
若将柠檬酸加热到150℃,则分子内失去一分子水而形成不饱和酸——顺乌头酸,后者在一定条件下会和水反应又生成柠檬酸和异柠檬酸两种异构体。
(1)写出顺乌头酸和异柠檬酸的结构简式:
顺乌头酸: 异柠檬酸: 。
(2)由柠檬酸转化为顺乌头酸的反应过程,属于 反应(填反应类型),
顺乌头酸转化为柠檬酸和异柠檬酸的反应过程,属于 反应(填反应类型)。
(3)传统塑料增塑剂为邻苯二甲酸双酯(DEHP)。因其结构中含苯环,可能致癌。柠檬酸酯无毒无味,可替代传统增塑剂。请写出用柠檬酸合成柠檬酸三乙酯(TEC)的化学方程式:
。
27.(10分)有机化合物A广泛存在于水果肉中,尤以苹果、葡萄、西瓜、山楂内为多。已知:
① A中碳和氢的质量分数之和为40.3%,其余为氧;其相对分子质量大于110,小于150。
② A与乙酸或丙醇在浓硫酸、加热的条件下生成有香味的产物;
③ 1molA与足量的钠最多能产生1.5 mol气体;
④ A在一定温度下脱水得到产物B(不是环状化合物),B可以和溴水发生加成反应。
试回答:
(1)A的分子式为 。
(2)对A的结构可作出的判断是 (多选扣分)。
(a)肯定有碳碳双键 (b)有两个羧基
(c)肯定有羟基 (d)有一COOR官能团
(3)有机物A的结构简式(不含一CH3)为 、 。
(4)A在一定温度下的脱水产物B具有顺反异构现象,B和溴水反应的化学方程式:
。
化学科答题卷
高二(__) 学号______ 姓名__________ 成绩____
第一部分 选择题(共80分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
第二部分 非选择题(共70分)
三、(本题包括2小题,共20分)
21.(10分)
(1)__________________________________;(2)__________________________________;
(3)________________________;(4)___________________________;(5)___________;
(6)________________________________________________________________;_________。
22.(10分)
(1)__________________________________________________________________________;
(2)__________________________________________________________________________;
(3)_____________;_______________;
(4)
假设一:______________________________________________________________________;
假设二:______________________________________________________________________。
要点:_________________________________________________________________________
_______________________________________________________________________________。
四、(本题包括3小题,共30分)
23.(9分)
(1)____________________;(2)____________________;(3)____________________。
24.(10分)
(1)___________;(2)___________,___________;(3)_____________,_____________。
25.(11分)
(1)___________;(2)___________;(3)___________;(4)_______________________。
五、(本题包括2小题,共20分)
26.(10分)
(1)_______________________,_______________________;(2)___________;___________;
(3)__________________________________________________________________________。
27.(10分)
(1);___________;(2)___________;
(3)_______________________,_______________________;
(4)__________________________________________________________________________。