高中会考化学模拟卷(7)
应春晓 仙居城峰中学
可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32
一、选择题(本题有28小题,每小题2分,共56分。每小题只有1个选项符合题意,不选、多选、错选均不给分)
1.环保部门为了使城市生活垃圾得到合理利用,近年来逐步实施了生活垃圾分类投放的办法。其中塑料袋、废纸、旧橡胶制品等属于
A 无机物 B 有机物 C 盐类 D 非金属单质
2.下列物质中属于合金的是
A、黄金 B、白银 C、钢 D、水银
3.下列化学名词正确的是
A、溴笨 B、烧碱 C、乙酸乙脂 D、溶量瓶
4. 下列物质属于纯净物的是
A、煤 B金刚石 C石油 D空气
5.在国际单位制中,摩尔质量的基本单位是
A、Kg B、mol C、m3 D、g/mol
6.曾对化学平衡进行研究并提出平衡移动理论的化学家是
A、勒夏特列 B、门捷列夫 C、道尔顿 D、拉瓦锡
7.下列分子中的各原子均在同一直线上的是
A、C2H4 B、CH4 C、CH==CH D、CH3—CH3
8.今有0.1mol/L Na2SO4溶液300mL,0.1mol/L MgSO4溶液200mL和0.1mol/L Al2(SO4)3溶液100mL,这三种溶液中硫酸根离子浓度之比是
A 1︰1︰1 B 3︰2︰1
C 3︰2︰3 D 1︰1︰3
9. 下列过程中,不可逆的是
A.蛋白质的盐析 B.酯的酸催化水解
C. 氯化铁的水解 D. 蛋白质的变性
10.实验室用Al2(SO4)3制取Al(OH)3,最合适的试剂是
A.NaOH B.H2SO4 C.NH3·H2O D.KOH
11.有关化学用语正确的是
A、乙烯的最简式C2H4 B、乙醇的结构简式C2H6O
C、四氯化碳的电子式\S\UP8(.. D、臭氧的分子式O3
12.下列金属冶炼的反应原理,错误的是( )
A、2NaCl(熔融) 2Na + Cl2↑ B、MgO + H2 Mg + H2O
C、Fe2O3 + 3CO 2Fe + 3CO2 D、2Ag2O 4 Ag + O2↑
13.下列物质的溶液中,能发生银镜反应的是
A.乙酸 B.乙醇 C.乙醛 D. 乙酸乙酯
14.下列仪器中,不能用于加热的是
A.试管 B.量筒 C.烧杯 D.锥形瓶
15.将0.l mol·![]() 醋酸溶液加水稀释,下列说法正确的是
醋酸溶液加水稀释,下列说法正确的是
A.溶液中c(H+)和c(![]() )都减小
B.溶液中c(H+)增大
)都减小
B.溶液中c(H+)增大
C.醋酸电离平衡向左移动 D.溶液的pH增大
16.下列关于“过氧化氢”的说法中,正确的是
A、 过氧化氢可以发生分解反应
B、 过氧化氢是离子 化合物
C、 过氧化氢具有杀菌消毒作用,是强酸
D、过氧化氢是水的同分异构体
17.在下列过程中,需要增大化学反应速率的是
A. 钢铁腐蚀 B. 食物腐败 C. 塑料老化 D. 工业合成氨
18.与酸或碱都能反应的离子是
A.Fe3+ B. HCO3- C. AlO2- D. Al3+
19.下列叙述正确的是
A. 发生化学反应时失去电子越多的金属原子,还原能力越强
B. 金属阳离子被还原后,一定得到该元素的单质
C. 核外电子总数相同的原子,一定是同种元素的原子
D. 能与酸反应的氧化物,一定是碱性氧化物
20.下列离子方程式中正确的是
A、 小苏打溶液与稀硫酸混合:CO32-+2H+=CO2↑+H2O
B、 铝片与氢氧化钠溶液反应:Al+2OH-=AlO2-+H2↑
C、 大理石与盐酸反应:CaCO3+2 H+=Ca2++ H2O+ CO2↑
D、铁片放入硝酸银溶液中:Fe+Ag+=Fe2++Ag
21.设NA为阿佛加德罗常数,下列叙述中正确的是
A、在常温常压下,11.2LN2含有的分子数为0.5NA
B、在常温常压下,1mol Ne含有的原子数为NA
C、1 L 1 mol/L醋酸溶液中离子总数为2NA
D、18g水中所含的电子数为8NA
22.NaHCO3溶液中,各离子浓度关系中正确的是
A、c(Na+):c (HCO3_)>1 B、c(Na+):c (HCO3_)=1
B、c(Na+):c (HCO3_)<1 D、无法确定
23.青霉素试验针用它的稀释液(200国际单位青霉素/mL),现有1小瓶20万国际单位青霉素,1.0 mL注射器(分刻度0.1 mL),注射用水和几个干净小瓶。现取1.0 mL注射用水滴注入第一瓶内溶解青霉素。吸取0.1 mL溶液在第2瓶中用水稀释成1.0 mL。再吸取0.1 mL在第3瓶中稀释成1.0 mL,又……在第几个小瓶中稀释后青霉素浓度为200国际单位/mL:
A. 3 B. 4 C. 5 D. 6
24.下列实验中,正确的是
A. 实验室用氯酸钾制氧气结束时,先从水槽中移出导气管,再熄灭酒精灯
B. 称量固体时,将药品直接放在天平托盘上
C. 先将pH试纸用蒸馏水润湿后,再测定溶液的pH
D. 在量筒中稀释浓硫酸
25.若1 mol某气态烃CxHy完全燃烧,需用3 mol O2,则
A. x=2,y=2 B. x=2,y=4
C. x=3,y=6 D. x=3,y=8
26.下列电离方程式中,不正确的是
A、 Na2 SO4=2Na+ +SO42-
B、 CuCl2=Cu2+ +2Cl-
C、 CH3COOH![]() CH3COO-+H+
CH3COO-+H+
D、H2CO3![]() 2 H++ CO3
2 H++ CO3
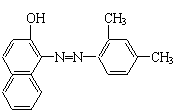 27.苏丹红是很多国家禁止用于食品生产的合成色素。结 构简式如右图。关于苏丹红说法错误的是
27.苏丹红是很多国家禁止用于食品生产的合成色素。结 构简式如右图。关于苏丹红说法错误的是
A、分子中含苯环
B、能溶于苯
C、能被酸性高锰酸钾溶液氧化
E、 属于芳香烃
28.能和氢氧化钠溶液反应的物质是
A.甲烷 B.甲苯 C.苯酚 D.乙烯
二.填空题(本题有3小题,共20分)
29.(10分)(1)写出乙醇与浓硫酸的混合液在170OC时发生反应的化学方程式 ▲ 。该反应属于 ▲ 反应
(2)写出甲苯和浓硝酸、浓硫酸的混合液反应的化学方程式 ▲
该反应属于 ▲ 反应
(3)写出NH4Cl水解的离子方程式 ▲ 。
30.(6分)[本题包括2小题,每位同学只需要选做一小题,若两题都做,按第(1)小题计分。]
(1) A是石油化工的原料,C是食醋的主要成分,D是具有果香味的液体。在一定条件下,它们的衍变关系如下:
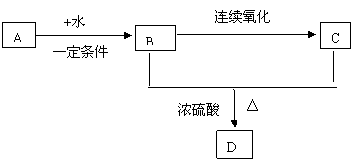
试写出A、B、C的结构简式:
A ▲ ,B ▲ ,C ▲ 。
(2) A、B、C、D四种短周期元素,其原子序数依次增大,这四种元素种只有D为金属元素;A与D同主族,B原子的最外层电子数是次外层电子数的2倍,C元素为地壳中含量最多的元素,D原子的最外层只有一个电子。据此回答下列问题:
(1)写出B、C、D的元素符号:B , D 。
(2)写出BC2与D2C2反应的化学方程式:
31.(4分)在一定条件下,可逆反应:CO (g)+ H2O(g)![]() CO2(g)+ H2(g) ,若升高
CO2(g)+ H2(g) ,若升高
温度,平衡向正反应方向移动。
请回答下列问题:
(1)该反应的正反应为 ▲ 反应。(填“吸热”或“放热”)
(2)若扩大容器的体积,则该反应速率将 ▲ (填“增大”、“不变”或“减小”)
三、简答题(本题有2小题,共12分)
32.(6分)请按要求填空:
(1)在配制Al2(SO4)3溶液时,为了防止发生水解,可以加入少量的____________
(2)乙烯是石油裂解的主要产物之一,将乙烯通入溴的四氯化碳溶液中,观察到的现象是
(3)实验室检验醛基的常用试剂是
33.(6分)如下图所示,A、B、C是实验室常用的三种制取气体的装置,提供的药品有:大理石、浓盐酸、稀盐酸、锌粒、二氧化锰、氯化铵、熟石灰.现欲利用这些药品分别制取NH3、Cl2、H2、CO2四种气体,试回答以下问题.
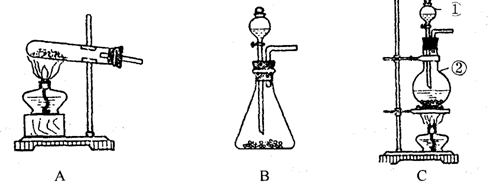
(1) 选用B装置可制取的气体有________________
(2) (2)标号①、②的仪器名称依次为________________ ,________________
(3)写出利用上述有关药品制取氨气的化学方程式:___________________________________
若要制得干燥的氨气,可选用下列干燥剂中的________________(填序号)
a.生石灰 b,浓硫酸 C.三五氧化二磷
四、计算题(本题有2小题,共12分)
34.(6分)1.12L(标准状况下)某气态烃(CnHm)在足量的氧气中完全燃烧,将燃烧产物依次通过足量的浓硫酸和澄清石灰水,浓硫酸增加4.5g,,并产生20g白色沉淀.
(1) 试求出该烃的分子式.
(2) 写出该烃可能的结构简式.
35. (6分)在(NH4)2SO4中加入足量的NaOH溶液,加热,充分反应后产生4.48L气体(标准状况下).求(NH4)2SO4的质量.
一、 单项选择题(每题2分,共56分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| B | C | B | B | D | A | C | D | D | C | D | B | C | D |
| 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 |
| D | A | D | B | C | C | B | A | B | A | B | D | D | C |
二、 填空题(分)
29 (1)C2H5OH→C2H4↑+ H2O(条件浓硫酸,170oC肩头上写不上)。消去反应
(2)C6H5–CH3+3HNO3→三硝基甲苯+3H2O 取代反应
(3)NH4++H2O![]() NH3*H2O+OH-
NH3*H2O+OH-
30. (1)A CH2=CH2 B C2H5OH C CH3COOH
(2)B C ,D Na
2CO2+2Na2O2=2Na2CO3+O2
31, (1) 吸热
(2) 减小
三、简答题
32. (1)硫酸,
(2) 溴的红棕色褪去,
(3)银氨溶液或者新制的氢氧化铜溶液
33 (1)CO2 H2 (1分)
(2)分液漏斗 ,圆底烧瓶 (每空1分)
(3) 2 NH4Cl+Ca(OH)2====2NH3↑+2H2O+CaCl2、(2分)
(4)a(1分)
四计算题(12分)
34 (1)C4H10 (2) CH3CH2CH2CH3或者CH3CH(CH3))CH3
35解:设(NH4)2SO4有m g,则根据题意可得
(NH4)2SO4→2NH3
132g/mol 44.8L/mol
m g 4.48L
可以得出m=(132g/mol×4.48L)÷44.8L/mol=13.2g
答:(NH4)2SO4的质量为13.2g