高中会考化学模拟卷(8)
考生须知:
1.全卷分试卷Ⅰ、Ⅱ和答卷Ⅰ、Ⅱ,试卷共6页,有4大题,34小题,满分为100分。考试时间90分钟。
2.本卷可能用到的相对原子质量数据:H-1,C-12,O-16,S-32, Mg-24,Al-27,Cl-35.5。
试卷 Ⅰ
一、选择题(本题有28小题,每小题2分,共56分。每小题只有1个选项符合题意,不选、多选、错选均不给分)
1.2008年夏季奥运会将在北京举行,届时要突出“绿色奥运、科技奥运、人文奥运”理念。绿色奥运是指( )
A.加大反恐力度,并讲求各国运动员的营养搭配,使他们全身心投入比赛。
B.严禁使用兴奋剂,使运动员公平竞争
C.把环境保护作为奥运设施规划和建设的首要条件
D.奥运场馆建设均使用天然材料,不使用合成材料
2.我国三峡工程所提供的清洁、廉价、大功率、可再生的水电,相当于每年燃烧3×107t原煤的火力发电厂的电能。因此三峡工程有助于控制( )
A.酸雨 B.温室效应 C.白色污染 D.臭氧层空洞
3.下列几种酸中,酸性最弱的是( )
A. 苯酚 B.碳酸 C.磷酸 D.硫酸
4.P2O5可用作干燥剂,但下列气体不能用P2O5干燥的是( )
A.O2 B.CO2 C.Cl2 D.NH3
5.变质的油脂有难闻的哈喇味,这是因为发生了( )
A.加成反应 B.取代反应 C.水解反应 D.氧化反应
6.下列液体中,pH>7是
A.人体血液 B.橙汁 C.雪碧汽水 D.胃液
7.与盐酸、氢氧化钠溶液都能反应的物质是
A.AlCl3 B.FeCl3 C.Na2CO3 D.Al(OH)3
8.为了减少大气污染,北京市推广使用清洁汽车燃料。目前使用的清洁燃料主要有两类,一类是压缩天然气,另一类是液化石油气。这两类燃料的主要成分都是 ( )
(A)烃类 (B)一氧化碳 (C)氢气 (D)醇类
9.下列化合物中,只存在离子键的是
(A)NaOH (B)Na2O2 (C)NaCl (D)CO2
10.下列方法不能加快锌粒与1.0mol/L稀硫酸反应的速率的是( )
A.加热 B.加入少量硫酸铜 C. 增大压强 D.加入2mol/L的硫酸
11.如图是表示:2X+Y ![]() Z+R+Q的气体反应速率(υ)与时间(t)的关系,t1时开始改变条件,则所改变的条件符合曲线的是
v
Z+R+Q的气体反应速率(υ)与时间(t)的关系,t1时开始改变条件,则所改变的条件符合曲线的是
v
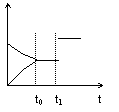 A.减少Z物质
A.减少Z物质
B.加大压强
C.升高温度
D.使用催化剂
12.加热下列物质,能发生氧化还原反应的是( )
A.碳酸氢铵 B.浓硝酸 C.浓盐酸 D.碳酸钙
13、设![]() 为阿伏加德罗常数,下列说法中正确的是
为阿伏加德罗常数,下列说法中正确的是
(A)2.4g金属镁与足量盐酸完全反应,失电子总数为![]()
(B)![]() 个二氧化碳分子的质量为44g
个二氧化碳分子的质量为44g
(C)0.1mol/L NaCl溶液中,![]() 与
与![]() 离子总数为
离子总数为![]()
(D)17g氨气中所含原子数为![]()
14.下列各组中的元素,属于同一周期的是
(A)O、Na、S (B)Mg、Al、P (C)N、O、Cl (D)H、Li、Na
15.下列各组离子中,在溶液里不能大量共存的是
(A)![]() 、
、![]() 、
、![]() (B)
(B)![]() 、
、![]() 、
、![]()
(C)![]() 、
、![]() 、
、![]() (D)
(D)![]() 、
、![]() 、
、![]()
16.下列说法中,正确的是
(A)用NaOH清洗沾在皮肤上的H2SO4
(B)中和滴定时盛待测液的锥形瓶应用待测液润洗
(C)用稀硝酸洗去残留在试管壁上的银
(D)用酒精萃取碘水中的碘
17.下列离子方程式中,不正确的是
(A)氯化镁溶液跟氢氧化钠溶液反应![]()
(B)硫酸溶液跟氢氧化钡溶液反应![]()
(C)氯气通入氯化亚铁溶液中![]()
(D)二氧化硫通入溴水使其褪色
![]()
18. 常温下,甲、乙两溶液的pH值分别为6和8,下列说法正确的是
(A)甲中H+数目不一定为乙中的100倍 (B)甲可能是稀氨水
(C)乙可能是稀醋酸 (D)甲不可能是强酸,乙不可能是强碱溶液
![]()
![]()
![]()
![]() 19. 下列物质不属于羧酸的是 O O
19. 下列物质不属于羧酸的是 O O
(A)CH3COOH (B)HOOC—COOH (C) HO—C—OH (D) C6H5—C—OH
20.下列反应能产生淡黄色沉淀的是
(A)溴乙烷中加入AgNO3溶液 (B)向氯水中加入AgNO3溶液
(C)苯酚溶液中滴入浓溴水 (D)溴乙烷与NaOH溶液混合,再加入AgNO3溶液
21. 实验室用Al2(SO4)3制取Al(OH)3,最合适的试剂是
(A)NaOH (B)H2SO4 (C) NH3·H2O (D) KOH
22.下列物质的水溶液其pH值大于7的是( )
A.NH4Cl B.Na2SO4 C.KNO3 D.Na2CO3
23. 要实现下列变化,需要还原剂的是
![]()
![]()
![]()
![]() (A)HCl Cl2 (B)Fe3+ Fe2+ (C) Al3+
AlO2— (D) C2H5OH
CH3CHO
(A)HCl Cl2 (B)Fe3+ Fe2+ (C) Al3+
AlO2— (D) C2H5OH
CH3CHO
24. X、Y都是短周期元素,若X的原子序数为n,X2+与Y2—具有相同的电子层结构,则Y的原子序数是
(A)n-4 (B)n-2 (C) n+2 (D) n+4
25.下列各组物质互为同分异构体的是
(A)苯酚和苯甲醇 (B) 乙烯和聚乙烯
(C)乙苯和邻二甲苯 (D) 1-己烯和苯
26.下列各组物质,常温下能起反应产生气体的是( )
A.铁与浓硫酸 B.铝与浓硝酸 C.铜与稀盐酸 D.铜与浓硝酸
27. 下列有关有机物的命名,不正确的是
(A)2—甲基戊烷 (B)2,2—二甲基丁烷
(C) 3,4—二甲基戊烷 (D) 3—乙基戊烷
28.相同质量的镁和铝,分别跟足量的盐酸反应,生成氢气的在相同状态时的体积比为( )
A.1:1 B.3:4 C.2:3 D.1:2
试 卷 Ⅱ
二、填空题(本题共3小题,共20分)
29.⑴写出苯酚与溴水发生反应的化学方程式__________________________________
该反应属于_________反应。
⑵除去乙酸乙酯中混有的乙酸,可用的除杂试剂为______________,除杂方法为__________。
30.试分析下图中各物质间的反应关系。

已知A是地壳中含量最高的金属元素的单质,写出上列各步反应的离子方程式。
(I)______________________________________________________________
(II)_____________________________________________________________
(III)____________________________________________________________
(IV)____________________________________________________________
31.向纯碱溶液中滴加酚酞溶液,观察到的现象是________________________,原因是___________________________________________,若再向该溶液中滴加过量的氯化钙溶液,观察到的现象_________________________________________________________.
三、实验题:(本题共1小题,共12分)
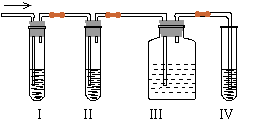 32、(12分)在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2。回答下列问题:
32、(12分)在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2。回答下列问题:
(1)I、II、III、IV装置可盛放的试剂是I ;II ;III ;IV (将下列有关试剂的序号填入空格内)。
A.品红溶液 B.NaOH溶液 C.浓硫酸 D.酸性KMnO4溶液
(2)能说明SO2气体存在的现象是 。
(3)使用装置II的目的是 。
(4)使用装置III的目的是 。
(5)确定含有乙烯的现象是 。
四、计算题:(本题共2小题,每小题6分,共10分)
33.(6分)测定有机物中碳和氢的质量分数最常用的方法是燃烧分析法,某实验工作者将3.2g气体样品放在氧气流中充分燃烧,将燃烧后的产物依次通过无水CaCl2和碱石灰,结果无水CaCl2增重7.2g,碱石灰增重8.8g。
⑴该有机物中碳的质量分数是_______ 。
⑵实验测得,在标准状况下,0.5g该气体体积为700mL,则这种烃的相对分子质量是_____。
⑶根据以上数据推算,该有机物的化学式是_________。
34.(6分)用铜与浓硫酸反应,得到SO2的体积为4.48L(标准状况下)。
计算:(1)被还原的硫酸的物质的量?
(2)把所得到的硫酸铜配制成500mL硫酸铜溶液,该溶液物质的量浓度
是多少?
参考答案:
一、
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| C | B | A | D | D | A | D | A | C | C | D | B | A | B |
| 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 |
| B | C | B | A | C | B | C | D | B | A | C | D | C | B |
二.
29.⑴略,取代反应 ⑵碳酸钠溶液,分液
30.略
31.溶液显红色。碳酸钠水解使溶液呈碱性(或写水解的离子方程式),使溶液呈红色。Ca2+ + CO32— = CaCO3↓使水解平衡向左移动,OH-离子的浓度减小,溶液褪色。
32.⑴A;B;A;D ;⑵I中的品红褪色;
⑶除去乙烯中SO2气体;⑷检验SO2是否已除尽; ⑸Ⅲ中的品红不褪色,Ⅳ酸性高锰酸钾溶液褪色。
33.75%;16;CH4
34.0.2mol;0.5mol/L