选修III 《物质结构与性质》第三章 晶体结构与性质测验卷
一、选择题(每题有1-2个正确答案,每小题4分,合60分)
1、空间构型为正四面体,且键角为60∘的物质为 ( C )
A.金刚石 B.SiO2 C.白磷 D.石墨
2、下列式子中,真实表示物质分子组成的是 ( A )
A、H2SO4 B、NH4Cl C、SiO2 D、C
3、直接由原子构成的一组物质是 ( B )
A、碘、二氧化硅、金刚石 B、硅晶体、金刚石、二氧化硅晶体
C、氧化钙、金刚石、二氧化硅晶体 D碘、石墨、黄铁矿
4、下列各组物质中,化学键类型相同、晶体类型也相同的是 ( AC )
A、CaCl2和Na2O B、碘、氖 C、CO2和H2O D、CCl4和KCl
5、下表列出了有关晶体的说明,有错误的是 ( CD )
| 选项 | A | B | C | D |
| 晶体名称 | 碘化钾 | 干冰 | 氖 | 二氧化硅 |
| 组成晶体微粒名称 | 阴、阳离子 | 分子 | 原子 | 分子 |
| 晶体内存在的结合力 | 离子键 | 范德华力 | 共价键 | 范德华力 |
6、有关晶体的下列说法中正确的是 ( B )
A.晶体中分子间作用力越大,分子越稳定
B.原子晶体中共价键越强,熔点越高
C.冰熔化时水分子中共价键发生断裂
D.氯化钠熔化时离子键未被破坏
7、下列分子晶体: ①HCl、②HBr、③HI、④CO、⑤N2、⑥H2沸点由高到低的顺序排列正确的是 ( C )
A.①②③④⑤⑥ B.③②①⑤④⑥
C.③②①④⑤⑥ D.⑥⑤④③②①
8、晶体结构属于面心结构的是 ( D )
A.NaCl B CsCl C CO2 D Cu
9、下面有关晶体的叙述中,错误的是 ( C )
A.金刚石的网状结构中,由共价键形成的最小碳环上有6个碳原子
B.在NaCl晶体中每个Na+(或Cl-)周围都紧邻6个Cl-(或6个Na+)
C.白磷晶体中,微粒之间通过共价键结合,键角为60°
D.离子晶体在熔化时,离子键被破坏,而分子晶体熔化时,化学键不被破坏
10、将下列晶体熔化:氢氧化钠、二氧化硅、氧化钙、四氯化碳,需要克服的微粒间的相互作用有:①共价键 ②离子键 ③分子间的作用力正确的顺序是 ( B )
A.①②②③ B。②①②③ C.②③②① D。①①②③
11、已知C3N4晶体很可能具有比金刚石更大的硬度,且原子间均以单键结合,下列关于C3N4晶体的说法正确的是 ( C )
A.C3N4晶体是分子晶体
B.C3N4晶体中,C-N键的键长比金刚石中的C-C键的键长要长
C.C3N4晶体中每个C原子连接4个N原子,而每个N原子连接3个C原子
D.C3N4晶体中微粒间通过离子键结合
12、X是核外电子数最少的元素,Y是地壳中含量最丰富的元素,Z在地壳中的含量仅次于Y,W可以形成自然界最硬的原子晶体。下列叙述错误的是 ( D )
A.WX4是沼气的主要成分 B.固态X2Y是分子晶体 。
C.ZW是原子晶体 D.ZY2的水溶液俗称水玻璃
13、下列晶体中,所含任何一个原子都被相邻的四个原子包围,以共价键形成正四面体结构,并向空间伸展形成网络状结构的是 ( C )
A.甲烷 B.石墨 C.单晶硅 D.水晶
14、硼能以B12正多面体基本结构单元接不同的连接方式形成多种单质晶体的变体。B12基本结构单元中含B原子12个,每个硼原子与邻近的5个硼原子等距离成键,每个面都是等边三角形,则B12正多面体的面数是 ( B )
A.10 B.20 C.30 D.60
15、六氟化硫分子呈正八面体,难以水解,在高电压下仍有良好的绝缘性,在电器工业有着广泛用途,但逸散到空气中会引起强温室效应。下列有关SF6的推测正确的是 ( C )
A.SF6易燃烧生成二氧化硫
B.SF6中各原子均达到 8 电子稳定结构
C.高温条件下,SF6微弱水解生成H2SO4和HF
D.SF6是极性分子
二、填空题
16、(6分)有A、B、C三种物质,每个分子都各有14个电子.其中A的分子属于非极性分子,且只有非极性键:B的分子也属于非极性分子,但既有极性键,又有非极性键;C
的分子属于极性分子。则A的电子式为![]() ,B的结构式为
,B的结构式为 ![]() 。C的名称是 一氧化碳 。
。C的名称是 一氧化碳 。
17、(7分)参考下表中各物质的熔点回答有关问题:
| 物质 | NaF | NaCl | NaBr | NaI | NaCl | KCl | RbCl | CsCl |
| 熔点(℃) | 995 | 801 | 755 | 651 | 801 | 776 | 715 | 646 |
| 物质 | SiF4 | SiCl4 | siBr4 | SiI4 | SiCl4 | GeCl4 | SnCl4 | PbCl4 |
| 熔点(℃) | -90.2 | -70.4 | -5.2 | 12.5 | -70.4 | -49.5 | -36.2 | -15.0 |
(1)钠的卤化物及碱金属的氯化物的熔点与 离子键强弱 有关,随着 卤素离子半径增大,键长 增大键能减小,故熔点依次降低。
(2)硅的卤化物的熔点与 分子间作用力强弱 有关,随着 相对分子量 增大 分子间作用力 增大,故熔点依次升高。
(3)钠的卤化物的熔点比相应的硅的卤化物的熔点高得多,这与 晶体类型/微粒间作用力 有关,因为 离子晶体/离子键的强度远大于分子间作用力 ,故前者的熔点远高于后者。
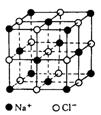 18.(12分)下面是一种简单可行的测定阿伏加德罗常数的步骤:
18.(12分)下面是一种简单可行的测定阿伏加德罗常数的步骤:
1将固体NaCl细粒干燥后,准确称取mgNaCl固体
并转移到定容仪器A中;
2用滴定管向A仪器中加苯,不断振荡,继续加苯
到A仪器的刻度,计算出NaCl固体的体积Vcm3。
请回答下列问题
(1)步骤11)中A仪器最好使用__C____(填序号)
A.量筒 B.烧杯 C.容量瓶 D.试管
(2)步骤2中用酸式滴定管还是用碱式滴定管____酸式滴定管___理由是_苯是优良的有机溶剂,会溶解碱式滴定管下端的橡胶管。
能否用水代替苯____不可以___理由是氯化钠会溶于水后的体积<水的体积+氯化钠固体的体积,导致测量氯化钠的体积不准确。
(3)已知NaCl晶体中,靠得最近的Na+与Cl—间的平均距离为acm(如右图),用上述测定方法测得的阿伏加德罗常数NA的表达式为![]() 。
。
19.(6分)(1)在金刚石立体网状结构中,由共价键形成的碳原子环中,最小的环上有___6____个碳原子.
(2)在晶体二氧化硅中,最小的环上共有_____8__个原子.
(3)石墨晶体的每一层是由无数个正六边形构成的,则平均每一个正六边形所占有的碳原子数为___2___个.
三、计算题(9分)
20、金属的性质与其结构有密切的关系,金属晶体由于某些结构上的相似点导致了金属具有一些共同的性质;同样由于结构上的不同点,导致了每种金属都具有各自的特性:
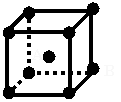 (1)请指出金属具有延展性的原理是:金属晶体中自由电子与金属阳离子形成金属键,当金属阳离子层与层之间发生相对移动时,自由电子可与金属阳离子迅速形成新的金属键,所以金属具有延展。
(1)请指出金属具有延展性的原理是:金属晶体中自由电子与金属阳离子形成金属键,当金属阳离子层与层之间发生相对移动时,自由电子可与金属阳离子迅速形成新的金属键,所以金属具有延展。
(2)金属的紧密堆积有不同的形式,请画出金属钠的晶胞,并指出一个晶胞含有几个钠原子? 2个钠原子
(3)计算该晶胞的空间利用率?
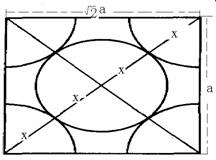 解:设该晶胞的边长为a m 则该晶胞的体积V立方体=a3
m3
解:设该晶胞的边长为a m 则该晶胞的体积V立方体=a3
m3
由于此晶胞是紧密堆积则可以画出:则可知4x=![]() a,则x=
a,则x=![]() a
a
由于此晶胞中有两个钠原子,而一个钠的体积为V球=![]() =
=![]()
则此晶胞的空间利用率=![]() *100%=
*100%=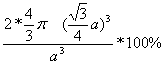 =
=![]() =68%
=68%