高二化学《电离平衡》单元测试题
一、选择题(本题共26小题,每题2分计52分,每小题只有一个选项符合题意)
1、氨水中所含有的分子和离子有( )
①![]() ②H2O ③NH3 ④NH3·H2O ⑤H+ ⑥OH-
②H2O ③NH3 ④NH3·H2O ⑤H+ ⑥OH-
A.①②③ B.②③④⑤ C.②③④⑤⑥ D.①②③④⑤⑥
2、下列物质属于电解质的是( )
A. Cu B. 液态NH3 C. CO2 D. Na2O2固体
3、下列方程式书写正确的是( )
A.NaHSO4在水溶液中的电离方程式:NaHSO4=Na++HSO4-
B.H2SO3的电离方程式H2SO3![]() 2H++SO32-
2H++SO32-
C.CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D.CaCO3的电离方程式:CaCO3=Ca2++CO32-
4、下列溶液一定呈中性的是( )
A.pH=7的溶液 B.c(H+)=c(OH-)=10-6mol/L溶液
C.使石蕊试液呈紫色的溶液 D.酸与碱恰好完全反应生成正盐的溶液
5、下列溶液中导电性最强的是( )
A.![]() 醋酸 B.
醋酸 B.![]() 溶液
溶液
C.![]() 盐酸 D.
盐酸 D.![]() 溶液
溶液
6、 现有浓度为1 mol/L的五种溶液:①HCI,②H2SO4,③CH3COOH,④NH4Cl,⑤NaOH,由水电离出的C(H+)大小关系正确的是( )
A.④>③>①=⑤>② B.①=②>③>④>⑤
C.②>①>③>④>⑤ D.④>③>①>⑤>②
7、下列离子在溶液中能大量共存的是( )
A. Cu2+ Na+ NO![]() S2- B. Mg2+ H+ SO
S2- B. Mg2+ H+ SO![]() NO
NO![]()
C. Al3+ Na+ HCO![]() SO
SO![]() D. Fe3+ H+ SCN- Cl-
D. Fe3+ H+ SCN- Cl-
8、常温下将10ml PH=13的Ba(OH)2溶液加水稀释至100ml,所得溶液的PH为( )
A. 14 B. 12.7 C. 12 D. 10
9、等体积等物质的量浓度的MOH强碱溶液和HA弱酸溶液混合后,混合溶液中有关离子浓度关系正确的是( )
A. C(M+)>C(OH-)>C(A-)>C(H+) B. C(M+)>C(A-)>C(H+)>C(OH-)
C. C(M+)>C(A-)>C(OH-)>C(H+) D. C(M+)+ C(H+)>C(A-)+ C(OH-)
10、在室温下等体积的酸和碱的溶液,混合后PH一定等于7的是( )
A. PH=3的硝酸和PH=11的Ba(OH)2溶液 B. PH=3的盐酸和PH=11的氨水
C. PH=3的硫酸和PH=11的氨水 D. PH=3的醋酸和PH=11的Ba(OH)2溶液
11、PH相同的氨水、NaOH和Ba(OH)2溶液,分别用蒸馏水稀释到原来的X、Y、Z倍,稀释后三种溶液的PH仍然相同,则X、Y、Z的关系是( )
A. X=Y=Z B.X>Y=Z C.X<Y=Z D.X=Y<Z
12、能影响水的电离平衡,并使溶液中c(H+)>c(OH-)的措施是( )
A.将水加热煮沸,测得pH=6 B.向纯水中投入一小块金属钠
C.向水中加入NH4Cl固体 D.向水中加入Na2CO3固体
13、在48mL0.1mol/LHNO3溶液中加入12mL0.4mol/LKOH溶液时, 所得到的溶液呈( )
A. 弱酸性 B. 强酸性 C. 碱性 D. 中性
14、0.1mol/LNaOH溶液和0.1mol/LNH4Cl溶液等体积混合后,溶液中离子浓度大小顺序正确的是
A.c(Na+)>c(Cl-)>c(OH-)>c(H+) B.c(Na+)=c(Cl-)>c(H+)>c(OH-)
C.c(Cl-)>c(Na+)>c(OH-)>c(H+) D.c(Na+)=c(Cl-)>c(OH-)>c(H+)
15、HClO是比H2CO3还弱的酸,当反应Cl2+H2O![]() HCl+HClO达到平衡后,要使HClO的浓度增加,可加入( )
HCl+HClO达到平衡后,要使HClO的浓度增加,可加入( )
A.NaOH固体; B.NaCl固体; C.H2O D.CaCO3固体
16、将PH为8的NaOH溶液与PH为10的NaOH溶液等体积混合后,溶液的氢离子浓度最接近于 ( )
A.2×10-10mol/L B.1/2(10-8+10-10)mol/L C.(10-8+10-10)mol/L D.1/2(10-6+10-4)
17、0.1mol/LK2CO3溶液中, 由于CO32-的水解, 使得c(CO32-)<0.1mol/L. 如果使c(CO32-)更接近于0.1mol/L, 可以采取的措施是( )
A. 加入少量盐酸 B. 加入适量水 C. 加入适当KOH D. 加热
18、CH3COOH溶液与NaOH溶液反应, 若反应后溶液的pH为7,那么( )
A .CH3COOH与NaOH的质量相等 B. CH3COOH与NaOH的物质的量相等
C. NaOH过量 D. CH3COOH过量
19、在一个盛有20mL0.1mol/LNaOH溶液和10mLH2O的容器中, 逐滴加入0.1mol/LHCl溶液, 当容器中的碱溶液恰好被加入的酸溶液中和时,容器内溶液的总体积约是( )
A .40mL B. 50mL C. 60mL D. 70mL
20、下列事实一定能说明HF是弱酸的是( )
①常温下NaF溶液的pH大于7; ②用HF溶液做导电性实验,灯泡很暗;
③HF与NaCl不能发生反应; ④常温下0.1mol/L的HF溶液的pH为2.3
⑤HF能与Na2CO3溶液反应,产生CO2气体 ⑥HF与水能以任意比混溶
⑦1mol/L的HF水溶液能使紫色石蕊试液变红
![]() A.①②⑦ B.②③⑤
C.③④⑥
D.①④
A.①②⑦ B.②③⑤
C.③④⑥
D.①④
21、向CH3COOH CH3COO- + H+ 的平衡体系中,加入下列物质能使醋酸的电离
程度和溶液的pH都变小的是( )
A .H2O B. CH3COONa C. NH3·H2O D. H2SO4
22、某酸碱指示剂(HIn)在水溶液中存在以下平衡:
HIn(aq) ![]() H+ +
In—(aq)
H+ +
In—(aq)
(红色) (蓝色)
下列物质的溶液中,能使指示剂显蓝色的是( )
A.稀硫酸 B.氯化铝溶液 C.稀氨水 D.饱和食盐水
23、用pH试纸测某溶液的pH时,规范的操作是( )
A.将pH试纸放入溶液,观察其颜色变化,跟标准比色卡比较
B.用干燥的洁净玻璃棒蘸取溶液,滴在pH试纸上,跟标准比色卡比较
C.用蒸馏水湿润pH试纸,用玻璃棒蘸取溶液,滴在pH试纸上,跟标准比色卡比较
D.在试管内放入少量溶液煮沸,把pH试纸放在试管口上观察,跟标准比色卡比较
24、某同学的实验报告中有如下数据,其中数据合理的是( )
A.用托盘天平称取3.25gNaCl B.用酸式滴定管量取20.00mLKMnO4溶液
C.用量筒量取10.51mL盐酸 D.用容量瓶配制216mL0.1mol/L的NaOH溶液
25、为了配制NH4+的浓度与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入:
①适量的HCl;②适量的NaCl;③适量的氨水;④NaOH
A.①② B.③ C.③④ D.④
26、pH=13的 强碱与pH=2的强酸溶液混合,所得混合液的pH=11,则强碱与强酸的体积比为
A.9:1 B.1:11 C.1:9 D.11:1
二、填空题(共34分)
27、(共4分)(1)将等质量的Zn粉分别投入:a:10ml 0.1mol·L-1 HCl和b:10ml 0.1mol·L-1醋酸中。
①若Zn不足量,则反应速率a b(填>=或<=)
②若Zn过量,产生H2的量a b(填>=或<=)
(2)将等质量Zn粉分别投入PH=1体积均为10ml的a:盐酸
b:醋酸中
①若Zn不足量,则反应速率a b(填>=或<=)
②若Zn过量,产生H2的量a b(填>=或<=)
28、(11分)常温下,将0.01molNH4Cl和0.002molNaOH溶于水配成1L溶液,
(1)该溶液中存在的三个平衡体系是___________________、_____________________、__________________________________。
(2)溶液中共有 种不同的粒子。
(3)这些粒子中浓度为0.01mol/L的是 ,浓度为0.002mol/L的是 。
(4)物质的量之和为0.01mol的二种粒子是_______________________________________。
(5) 和 两种粒子数量之和比OH-多0.008mol
29、(3分)把AlCl3 溶液蒸干后再灼烧,最后得到的主要固体产物是 ,其理由是(用化学方程式表示,并配以必要的文字说明)____________________________
_____ __。
30、(12分)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序有以下几种
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
则⑴上述关系一定不正确的是 (填序号)
⑵若溶液中只有一种溶质,则该溶质为 ,该溶液中离子浓度的大小关系为 (填序号)
⑶若关系③正确,则溶液中溶质为 。
⑷若四种离子浓度关系有c(NH4+)=c(Cl-),则该溶液显 (填“酸性”、“碱性”、“中性”)。
⑸25℃,pH=a的盐酸VamL与pH=14-a的氨水VbmL混合,若溶液显中性,则
Va Vb(填“>”、“<”、“=”、“无法确定”)
31、(4分)在0.2mol/L氨水中存在着下列平衡:NH3+ H2O![]() NH3·H2O
NH3·H2O![]() NH4+ +OH-,当改变条件时,表中各项内容有何变化:
NH4+ +OH-,当改变条件时,表中各项内容有何变化:
| 改变条件 | 平衡移动方向 | PH值 | C(NH4+) |
| 通入氨气至饱和 | |||
| 加入少量盐酸 | |||
| 加入少量NH4Cl | |||
| 加水稀释 |
三、实验题(14分)
32、(4分)限使用下列试剂:酚酞溶液、石蕊试液、稀氨水、氯化铵晶体、浓盐酸、熟石灰粉末、醋酸铵晶体和蒸馏水。根据(1)弱碱在水中存在电离平衡。(2)弱碱的阳离子会破坏水的电离平衡。这两种平衡移动均会引起指示剂颜色变化。由此可分别选用上述试剂,设计两个实验证明NH3·H2O是弱碱。请简述实验方法及现象。
(1)应用根据(1)的实验方法及现象_____________________。
(2)应用根据(2)的实验方法及现象_____________________。
33、(10分)阅读下列实验内容,根据题目要求回答问题。
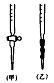 某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14mol·L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL。
某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14mol·L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL。
(1)该学生用标准0.14mol·L-1 NaOH溶液滴定硫酸的实验操作如下:
A、用酸式滴定管取稀H2SO4 25.00mL,注入锥形瓶中,加入指示剂。
B、用待测定的溶液润洗酸式滴定管
C、用蒸馏水洗干净滴定管
D、取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2—3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
E、检查滴定管是否漏水
F、另取锥形瓶,再重复操作一次
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
①滴定操作的正确顺序是(用序号填写) ;
②该滴定操作中应选用的指示剂是 ;
③在G操作中如何确定终点? 。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”) 。
(3)配制准确浓度的稀H2SO4溶液,必须使用的主要容器是
(4)如有1mol/L和0.1mol/L的NaOH溶液,应用_____ _的NaOH溶液,原因是______________ ________。
(5)用标准NaOH溶液滴定时,应将标准NaOH溶液注入 __(选填“甲”或“乙”)中。
(6)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值 (选填“偏大”“偏小”或“无影响”)
(7)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度(计算结果到小数点后二位) 。
高二化学《电离平衡》单元测试题答卷
学号_________ 姓名 __ 班级 ___________ 成绩 ____________
一、选择题(本题共26小题,每题2分计52分,每小题只有一个选项符合题意)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | |||||||||||||
| 题号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 |
| 答案 |
二、填空题(共34分)
27、(共4分)(1)①a b ②a b(2)①a b ②a b
28、(11分)(1)_________ __________、
______________ _______、__________________________________。
(2)
(3) , 。
(4)_______________________________________。
(5) 和
29、(3分) ,其理由是__ __
_。
30、(12分)⑴ (填序号)
⑵ , (填序号)
⑶ 。
⑷
⑸Va Vb
31、(4分)
| 改变条件 | 平衡移动方向 | PH值 | C(NH4+) |
| 通入氨气至饱和 | |||
| 加入少量盐酸 | |||
| 加入少量NH4Cl | |||
| 加水稀释 |
三、实验题(14分)
32、(4分)
(1)____ ________
(2)______ ____ __。
33、(10分)(1)① ;② ;③ 。
(2) 。 (3)
(4)_____ _,原因是______________ ________。
(5) ___________
(6) ____
(7) ______。
阳江市一职中高二化学《电离平衡》单元测试题参考答案
一、选择题(本题共26小题,每题2分计52分,每小题只有一个选项符合题意)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | D | D | D | B | B | A | B | C | C | A | B | C | D |
| 题号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 |
| 答案 | D | D | A | C | D | B | D | D | C | B | B | B | C |
二、填空题(共34分)
27、(共4分)(1)①a > b ②a = b(2)①a < b ②a < b
28、(11分)(1)(各2分)NH3·H2O![]() NH4++OH-;
NH4++OH-;
NH4++H2O![]() NH3·H2O+H+;
NH3·H2O+H+;
H2O![]() H++OH-
H++OH-
(2)七(1分)
(3)Cl-;Na+(各1分)
(4)NH4+、NH3·H2O (1分)
(5)NH4+;H+(1分)
29、(3分)Al2O3(1分),其理由是AlCl3+3H2O![]() Al(OH)3+3HCl,HCl挥发,使水解平衡右移; 2Al(OH)3=Al2O3+3H2O (2分)
Al(OH)3+3HCl,HCl挥发,使水解平衡右移; 2Al(OH)3=Al2O3+3H2O (2分)
30、(12分) (各2分) ⑴ ②
⑵ NH4Cl,①
⑶ NH4Cl和NH3H2O
⑷ 中性
⑸ Va〉Vb
31、(4分)
| 改变条件 | 平衡移动方向 | PH值 | C(NH4+) |
| 通入氨气至饱和 | 右移 | 增大 | 增大 |
| 加入少量盐酸 | 右移 | 减小 | 增大 |
| 加入少量NH4Cl | 左移 | 减小 | 增大 |
| 加水稀释 | 右移 | 减小 | 减小 |
三、实验题(14分)
32、(4分)
(1)取少量稀氨水,滴入酚酞试液,溶液呈红色,加入醋酸铵晶体,溶液的红色变浅。
(2)取少量![]() 晶体,加蒸馏水溶解,滴入紫色石蕊试液,溶液变红色。
晶体,加蒸馏水溶解,滴入紫色石蕊试液,溶液变红色。
33、(10分)(1)①ECDBAGF;②酚酞;③无色变为浅红色(或粉红色)且半分钟不褪去。
(2)偏大
(3)100.00mL容量瓶
(4)0.1mol/L;溶液浓度越稀,误差就越小
(5)乙
(6)偏小
(7)4.20mol/L