高二化学上学期期中考试试卷(X科)
第I卷(选择题,共74分)
可能用到的相对原子质量:H 1 C 12 Cu 64 O 16
一、选择题(本题共14小题,每小题3分,共42分。每小题只有一个选项符合题意。)
1、关于溶液的酸性、酸性强弱的说法中,正确的是
A. 只要溶液里有H+,溶液就显酸性
B. H+浓度增大,溶液的酸性一定增强
C. H+浓度大于OH--浓度,溶液一定显酸性
D. 强酸溶液的酸性一定比弱酸溶液的酸性强
2.
E.
F.
G.
2. 将氨水缓缓地滴入盐酸中至中性,下列有关的说法中正确的是:①盐酸过量 ②氨水过量 ③ 恰好完全反应 ④ c (NH4+) = c(Cl-) ⑤c (NH4+) < c(Cl-)
A. ①⑤ B. ③④ C. ②⑤ D. ②④
3. 在一定的温度下,向0.2mol/LCH3COOH的溶液里加水稀释,下列各种量的变化中,变大的是①c(H+)的物质的量浓度 ②c(OH--)的物质的量浓度 ③c (CH3COO--)/c(CH3COOH) ④c(H+)·c(OH--)
A .① ④ B. ②③ C. ③④ D. ②④
4. 在密闭容器中进行化学反应:2SO2 + O2![]() 2SO3。已知反应过程中某一时刻SO2、O2、SO3浓度分别为0.2mol/L、0.1mol/L、0.2mol/L。当反应达到平衡时可能存在的数据是
2SO3。已知反应过程中某一时刻SO2、O2、SO3浓度分别为0.2mol/L、0.1mol/L、0.2mol/L。当反应达到平衡时可能存在的数据是
A、SO2为0.4mol/L、O2为0.2mol/L B、SO2为0.25mol/L
C、SO2、SO3都为0.15mol/L D、SO2为0.4mol/L
5. 温度一定时, 于密闭容器中发生可逆反应: mA(气)
+ nB(气) ![]() pC(气), 达到平衡后, 若将混合气体的体积压缩到原来的 1/2, 当再次达到平衡时, C的浓度为原平衡时C的浓度的 1 .9 倍, 则下列叙述中正确的是
pC(气), 达到平衡后, 若将混合气体的体积压缩到原来的 1/2, 当再次达到平衡时, C的浓度为原平衡时C的浓度的 1 .9 倍, 则下列叙述中正确的是
A. 平衡向逆反应方向移动 B. C气体的体积分数增大
C. 气体A的转化率升高 D. m + n > p
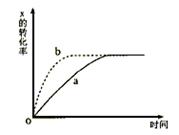
6.在密闭容器中进行下列反应:M(g)+N(g)![]() R(g)+2L,此反应符合下面图像,下列
R(g)+2L,此反应符合下面图像,下列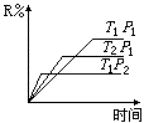 叙述正确的是
叙述正确的是
A. 正反应吸热,L是气体
B. 正反应吸热,L是固体
C. 正反应放热,L是气体
D. 正反应放热,L是固体或液体
7. 25℃四种水溶液①HCl,②FeCl3,③KOH,④Na2CO3其 PH值依次为4、4、10、10,而溶液中水的电离程度大小关系正确的是
A.①=②=③=④ B.①>③>②>④
C.④=②>③=① D.①=③>②=④
8. 将1molSO2和1molO2通入一体积不变的密闭容器中,在一定温度和催化剂作用下,反应达到平衡,SO3为0.3mol。此时若移走0.5molO2和0.5molSO2,则反应达到新的平衡时,SO3的物质的量为:
A.0.3mol B.0.15mol
C.小于0.15mol D.大于0.15mol,小于0.3mol
9. 含20.0克NaOH的稀溶液与稀盐酸反应,放出28.7kJ的热量,表示该反应中和热的热化学方程式正确的是
A.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);ΔH=+28.7kJ/mol
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);ΔH=-28.7kJ/mol
C.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);ΔH=+57.4kJ/mol
D.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);ΔH=-57.4kJ/mol
10. 右图曲线a表示放热反应X(g)+Y(g) ![]() Z(g)+M(g)+N(s)进行过程中X的转化率随时间
Z(g)+M(g)+N(s)进行过程中X的转化率随时间
|
曲线进行,可采取的措施是
A.升高温度 B.加大X的投入量
C.加催化剂 D.增大体积
11. 、恒温恒压下,在容积可变的器皿中,反应2NO2(g)![]() N2O4(g)达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数
N2O4(g)达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数
A. 不变 B. 增大 C. 减少 D. 无法判断
12. 物质的量浓度相同的下列各物质的溶液中,NH4+浓度由大到小的是
①NH4Al(SO4)2 ②NH4HCO3 ③NH4HSO4 ④NH4NO3
A、①③④② B、③①④② C、②④①③ D、①③②④
13. 下列说法中可以充分说明反应P(g)+Q(g) ![]() R(g)+S(g)在恒温条件下已达到平衡状态的是
R(g)+S(g)在恒温条件下已达到平衡状态的是
A.容器内的压强不随时间的变化而改变 B.P和R的生成速率相等
C.混合气体的密度不再随时间而变化 D.容器内P、Q、R、S共存
14.吸热反应一定是
①释放能量 ②吸收能量 ③反应物的总能量低于生成物的总能量
④生成物的总能量低于反应物的总能量
A、①③ B、①④ C、②③ D、②④
二、选择题(本题共8小题,每题4分,共32分。每小题有一个或两个选项符合题意。)
15. 将相同物质的量浓度的某弱酸HX溶液与NaX溶液等体积混合,测得混合后溶液中c(Na+)>c(X-),则下列关系错误的是
A.c(OH-)>c(H+) B.c(HX)<c(X-)
C.c(X-)+c(HX)=2c(Na+) D.c(HX)+c(H+)=c(Na+)+c(OH-)
16.pH值相等的盐酸(甲)和醋酸(乙),分别与锌反应,若最后锌已全部溶解且放出气体一样多,为此下列说法正确的是
A.反应开始时的速率:甲=乙 B.反应所需时间:甲<乙
C.反应开始时,酸的物质的量浓度:甲<乙 D.反应完后溶液的pH值:甲<乙
17.常温下设a代表Ba(OH)2,b代表NaOH溶液,c代表NH3·H2O溶液。下列说法正确的是
A、同物质的量浓度的三种溶液的pH:a>b>c
B、同pH时,三种溶液稀释相同倍数后,pH:a=b<c
C、同pH、同体积的三种溶液消耗同浓度盐酸的体积:a=b=c
D、同pH时,稀释不同倍数、pH仍相同,三种溶液稀释的倍数:a>b>c
18. 在常温下,将PH=11的某碱溶液与PH=3的某酸溶液等体积混合,对此下列说法正确的是 A
A.若所得溶液呈中性,则生成的盐可能为强酸强碱盐
B.若所得的溶液呈碱性,则可能是强碱与弱酸溶液反应
C.若所得溶液呈酸性,则可能是强酸与弱碱溶液反应
D.若所得溶液的PH=5,则可能强碱与弱酸溶液反应
19.把Ca(OH)2固体放入一定量的蒸馏水中,一定温度下达到平衡:Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq).当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是
Ca2+(aq)+2OH-(aq).当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是
A.溶液中Ca2+数目减少 B.溶液中c(Ca2+)增大
C.溶液pH值不变 D.溶液pH值增大
20. 已知某溶液中只存在OH--、H+、NH4+、Cl--四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系,其中不可能的是
A、c(Cl--)>c(NH4+)>c(H+)>c(OH--) B、c(Cl--)>c(NH4+)>c(OH--)>c(H+)
C、c(Cl-)>c(H+)>c(NH4+)>c(OH-) D、c(NH4+)>c(Cl-)>c(OH-)>c(H+)
21. 在容积一定的密闭容器中,反应2A![]() B(g)+C(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是
B(g)+C(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是
A.正反应是吸热反应,且A不是气态
B.正反应是放热反应,且A是气态
C.其他条件不变,加入少量A,该平衡向正反应方向移动
D. 改变压强对该平衡的移动无影响
22. 在100℃时,将0.50 mol N2O4气体通入到体积为5.0 L的真空密闭容器中立即出现红棕色,反应进行到2秒时,NO2的浓度为0.02 mol/L,60秒时体系已达平衡,此时容器内压强为开始的1.6倍,下列说法正确的是
A.前2秒以N2O4的浓度变化表示的平均反应速率为0.010 mol/(L·s)
B.在2秒时体系内压强为开始时的1.1倍
C.平衡时体系内含N2O4 为0.25mol
D.平衡时如果压缩容器体积,则可以提高N2O4的转化率
第II卷(非选择题,共76分)
三、(本题包括2小题,共20分)
23、(9分)现有0.1mol•L-1的纯碱溶液,试用PH试纸测定溶液的PH,其正确的操作是 。纯碱溶液呈碱性的原因(用离子方程式表示)是 - ,你认为该溶液PH的范围一定介于 。
为探究纯碱溶液呈碱性是由CO32-引起的,请你设计一个简单的实验方案。
。
24、(11)如图某化学实验小组从商店买回的浓硫酸试剂标签的部分内容,该小组在课外资料中获得以下信息:浓硫酸腐蚀性很强,溶于水时释放大量的热,浓硫酸的硫酸分步电离。
|
向HSO4- ![]() SO42- +
H+
SO42- +
H+
由于试剂瓶口密封签已破损,他们怀疑该硫酸质量分数与标签不符,确定开展研究.
甲认为可以用一种精密仪器测量该溶液的C(H+),若C(H+) =36.8 mol•L-1,该溶液的质量分数为0.98;
乙认为,即使有精密的仪器,甲方案也不行,建议用重量分析法来测。具体设想:取一定体积该硫酸和足量BaCl2反应,过滤、洗涤、干燥沉淀,称量沉淀的质量
丙则建议用“中和滴定”进行测量,设想如下:A、准确量取一定体积的硫酸,并用适量的水稀释;B、往稀释后溶液中滴入2-3滴酚酞;C、用一定浓度的NaOH溶液滴定,直到出现滴定终点为止;D、记录消耗的NaOH溶液的体积。
回答下列问题:。
(1)乙推断“甲同学方案不可行”的理由是: 。
(2)乙方案的关键操作有两点:①确保SO42-完全反应,②洗涤沉淀,确保沉淀不夹杂质。在实验中如何认定SO42-完全反应?
。
(3)如何稀释浓硫酸溶液?
。
(4)丙方案下列操作会使测定结果偏大 。
①在滴定前未用NaOH标准溶液润洗滴定管
②滴定前滴定管尖嘴部分有气泡,滴定后滴定管尖嘴部分气泡消失
③锥形瓶用水洗干净后,未用待测液润洗
④开始时平视读数,滴定完成时俯视读数
(5)丙在实验中,分别取硫酸5.00mL,用5.00mol/L NaOH滴定三次,终点时,得到的NaOH的体积依次为35.65mL、40.62mL、35.55mL,试通过计算该硫酸是否合格.(要计算过程)
四、(本题包括5小题,共43分)
25、(10分)
(1)把FeCl3溶液蒸干灼烧最后的产物是 。
(2)工业上制备纯净的氯化锌时,将含杂质的氯化锌溶于过量盐酸中,为了除去杂质需调节溶液的PH到4,应加入的试剂是 。
(3)3mol/L 100mL的H2SO4溶液与足量的Zn反应,为使产生的H2速率减慢,但产生H2的总量不变,可采取的措施 。(请填下列选项的序号)
①加固体CH3COONa ②BaCl2溶液 ③NH4Cl溶液 ④加氨水
(4)若1体积硫酸恰好与10体积PH=11的氢氧化钠的溶液完全反应,则二者物质的量浓度之比是 。
26、(4分)已知:2H2(g)
+ O2(g) == 2H2O(g);△H= –483.6
kJ·![]() , H2(g) + 1/2O2(g) == H2O(l)的△H=–285.8 kJ·
, H2(g) + 1/2O2(g) == H2O(l)的△H=–285.8 kJ·![]() ,由此可知,在等温下蒸发45g液态水需吸收_____ kJ的热量。27、(3分)甲同学向自制的少量Mg(OH)2沉淀中加入浓的CH3COONH4溶液,结果沉淀完全溶解,已知CH3COONH4溶液显中性,试用有关理论解释这一事实:
,由此可知,在等温下蒸发45g液态水需吸收_____ kJ的热量。27、(3分)甲同学向自制的少量Mg(OH)2沉淀中加入浓的CH3COONH4溶液,结果沉淀完全溶解,已知CH3COONH4溶液显中性,试用有关理论解释这一事实:
28、(12分)某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A=H++HA-
HA- ![]() H++A2-
H++A2-
回答下列问题:
(1) Na2A溶液显____________(填“酸性”,“中性”,或“碱性”)。
理由是____________________________________________(用离子方程式表示)
(2) 在0.1mol.L-1的Na2A溶液中,下列微粒浓度关系式正确的是__________
A c(A2-) +c( HA-)+c( H2A) =0.1mol·L-1 B c(OH-)=c(H+) +c( HA-)
C c(Na+ )+ c(H+) =c(OH-)+ c( HA-)+2c(A2-) D c(Na+ )= 2c(A2-) +2c( HA-)
(3) 已知0.1mol·L-1NaHA溶液的pH=2,则0.1mol·L-1 H2A溶液中氢离子的物质的量浓度可能是_______ 0.11 mol·L-1(填“〈”,“〉”,或“=”),理由是:
____________________________________________________________
(4) 0.1mol·L-1 NaHA溶液中各种离子浓度由大到小的顺序是:____________________
29、(14分)t℃时,将3mol A和1molB气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(g) + B(g) ![]() xC(g)
xC(g)
2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
(1) 从开始反应至达到平衡的状态,生成C平均反应速率为 .
(2) x= ;平衡常数K= .
(3) 若继续向原混合物的容器中通入少量氦气(设氦气和A、B、C都不反应)后,化学平衡(填字母) ;
A、向正反应方向移动 B、向逆反应方向移动 C、平衡不移动
(4)若向原平衡混合物的容器中再充入amolC,在t℃时达到新平衡,此时B的物质的量为n(B)= mol。
(5)如果上述反应在相同温度和容器中进行,欲使反应达到C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系式为:
。
五、(本题包括小题,共13分)
30. 在真空密闭容器内加入amolPH4I固体,在一定温度下发生如下反应:
PH4I(s)![]() PH3(g)
+ HI(g)
PH3(g)
+ HI(g)
4PH3(g)![]() P4(g)
+ 6H2(g)
P4(g)
+ 6H2(g)
2HI(g)![]() H2(g) + I2(g)
H2(g) + I2(g)
以上三反应建立平衡后,测得HI为bmol、I2(g)为cmol、H2为dmol。
求:
(1) 平衡后,容器内P4(g)和PH3的物质的量(用代数式表示):
n(P4))= ;n(PH3)=
(2)a、b、c三者服从a> (填b、c的代数式);
b、c、d三者的关系服从b> (填c、d的代数式)
(3)平衡后,增大压强,容器内n(I2) ,n(PH4I) (填增大、减小、不变)
化学试卷评分标准
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 答案 | C | D | B | B | A | C | C | C | D | C | A |
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 答案 | B | B | C | B | AC | AB | AD | AC | B | A | B |
三、(本题包括2小题,共20分)
![]() 23、(9分)把一小块试纸放在表面皿(玻璃片)上,用蘸有待测溶液的玻璃棒点在试纸的中部,试纸变色后,与标准比色卡比较来确定溶液的PH。(2分)CO32-
+H2O H CO3-
+ OH- ,(2分) 7-13 。(2分),
23、(9分)把一小块试纸放在表面皿(玻璃片)上,用蘸有待测溶液的玻璃棒点在试纸的中部,试纸变色后,与标准比色卡比较来确定溶液的PH。(2分)CO32-
+H2O H CO3-
+ OH- ,(2分) 7-13 。(2分),
(2)(3分)向纯碱溶液中滴加酚酞溶液,溶液显红色;若再向该溶液中滴入过量氯化钙溶液,产生白色沉淀,且溶液红色褪去。说明纯碱溶液呈碱性是由CO32-引起的。
24、(11)
答案:(1)浓硫酸属于弱电解质,不能完全电离.(2分)
(2)在上层清夜 (或取少量上层清夜置于小试管) 中,滴加BaCl2溶液,如果不产生沉淀,说明沉淀已经完全.(2分)
(3)取一定体积的水置于烧杯中,将浓硫酸缓缓加入水中,边加边搅拌.(2分)
(4) ① ② (2分)
(5)17.8mol/L<18.4mol/L(3分)因此,该硫酸不合格.
四、(本题包括4小题,共41分)
25、(10分)
(1)Fe2O3。 (2)ZnO或Zn(OH)2 (3)①② (4)5:1(4分)
26、(4分)110
27、(3分)Mg(OH)2(s)![]() Mg2++2OH-,加入铵盐后,NH4++OH-
Mg2++2OH-,加入铵盐后,NH4++OH-![]() NH3·H2O溶液中OH-离子浓度减小,溶解平衡向右移动,沉淀完全溶解.
NH3·H2O溶液中OH-离子浓度减小,溶解平衡向右移动,沉淀完全溶解.
28、(共12分)
(1)碱性, A2- + H2O ![]() HA- + OH-(各1分)
HA- + OH-(各1分)
(2)BCD (错选0分,3分) (
(3)< H2A第一步电离产生的H+,抑制了HA-的电离。(各2分)
(4)c(Na+ )> c(HA-)> c(H+)> c(A2-)> c(OH- ) (3分)
29、(14分)(其他各2分)
(1)0.2 mol•L-1•min-1(说明:不写单位扣分)
(2)4;1/27
(3)C
(4)(0.8+0.2a)(3分)
(5)n(A)=3n(B),n(C)≥0[或n(A)=n(B)=0,n(C)≥0]
五、
30. (13分)
答案:(其他各2分)
(1) n(P4) = (d-c)/6,n(PH3)=b+8 c /3 -2 d /3 (3分)
(2) a>b +2c;b>2d/3 -8c/3
(3) 减小;增大.