高二化学第一学期期中考试
试卷
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,全卷满分150分。考试时间120分钟。
第Ⅰ卷(选择题 共74分)
注意事项:
1.回答I卷前,考生务必在答题卡和答题纸姓名栏内写上自己的姓名、考试科目、准考证号等,并用2B铅笔涂写在答题卡上。
2.每小题选出正确答案后,用2B铅笔把答题卡上对应题号的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案。不能答在试题卷上。
3.考试结束,将答题卡和答题纸一并交回。
可能用到的原子量:H 1 C 12 N 14 O 16 Na 23 Al 27
S 32 Ca 40 Fe 56 Cu 64 Ag 108
一、选择题(本题包括8小题,每题4分,共32分。每小题只有一个选项符合题意)
![]() 1.在2CH4(g) + 2NH3(g) + 3O2(g)
2HCN(g) +
6H2O(g)反应中,已知v
(HCN) = n mol/(L·min),且v(O2)
= m mol/(L·min),则m与n的关系正确的是
1.在2CH4(g) + 2NH3(g) + 3O2(g)
2HCN(g) +
6H2O(g)反应中,已知v
(HCN) = n mol/(L·min),且v(O2)
= m mol/(L·min),则m与n的关系正确的是
A.![]() B.
B.![]() C.
C.![]() D.m = 2n
D.m = 2n
2.反应 A+B → C 的反应速率方程式为:v = k c (A) c (B), v为反应速率, k为速率常数。当c (A) = c (B) = 1mol/L时,反应速率在数值上等于速率常数。下列说法正确的是
A.只增大c (A)时,v也增大 B.只增大c (A)时,v值不变
C.只升高温度时,k值不变 D.只升高温度时,k值变小
3.一定温度下在容积恒定的密闭容器中,进行如下可逆反应:A(s)+2B(g)![]() C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是 ①混合气体的密度 ②容器内气体的压强 ③混合气体的总物质的量④B物质的量浓度
C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是 ①混合气体的密度 ②容器内气体的压强 ③混合气体的总物质的量④B物质的量浓度
A.①④ B.②③ C.②③④ D.只有④
4.向纯水中加入少量KHSO4(s),温度不变,则下列叙述正确的是
A.c(OH-)增大 B.c(H+)减小 C.c(OH-)与c(H+)之积增大 D.抑制了水的电离
5.关于盐类的水解反应的说法正确的是
A.溶液呈中性的盐一定是强酸与强碱生成的盐
B.含有弱酸根离子的盐的水溶液一定呈碱性
C.盐溶液的酸碱性主要决定于形成盐的酸、碱电离程度的相对大小
D.Na2 S水解的离子方程式为:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
6.下列现象或应用不能用胶体知识解释的是
A.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
B.牛油与Na0H溶液共煮,向反应后所得的溶液中加入食盐有固体析出
C.氯化铝溶液中加入小苏打溶液会产生白色沉淀和气体
D.水泥厂、冶金厂常用高压电除去工厂烟尘,减少对空气污染
7.实验室用铅蓄电池作电源电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应:负极:Pb + SO42- == PbSO4 + 2e 正极:PbO2 + 4H+ + SO42- + 2e == PbSO4 + 2H2O
若制得0.050mol Cl2,这时电池内消耗的H2SO4的物质的量至少是
A、0.025mol B、0.050mol C、0.10mol D、0.20mol
8.用两支惰性电极插入500mLAgNO3溶液中,通电电解。当电解液的pH从6.0变为3.0
时(设电解时阴极没有氢气析出,且电解前后体积变化可以忽略),电极上析出银的质
量大约是
A、27mg B、54mg C、108mg D、216mg
二、选择题(本题包括10小题,第9~16小题每小题4分,第17、18小题每小题5分,
共42分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,
该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得
满分,但只要选错一个,该小题就为0分)
9.在一密闭容器中,反应mA(g)+nB(g) ![]() 3C(g)达到平衡时,测得c(A)为0.5 mol/L在温度不变的情况下,将容积增大一倍,当达到新的平衡时,测得c(A)为0.25 mol/L。下列判断中正确的是
3C(g)达到平衡时,测得c(A)为0.5 mol/L在温度不变的情况下,将容积增大一倍,当达到新的平衡时,测得c(A)为0.25 mol/L。下列判断中正确的是
A.A的质量分数增加 B.平衡向逆反应方向移动
C.化学计量数:m+n=3 D.物质C的体积分数减小
10.在实验中不慎将手指被玻璃划破,可用氯化铁溶液应急止血,其主要原因是
A.FeCl3溶液具有杀菌消毒作用 B.FeCl3溶液能产生Fe(OH)3沉淀堵住伤口
C.含有的铁元素对人体有益 D.FeCl3溶液能使血液聚沉
11.下列关于铜电极的叙述正确的是
A、铜锌原电池中铜是正极 B、用电解法精炼铜时粗铜作阴极
C、在镀件上电镀铜时可用金属铜作阳极 D、电解稀硫酸制H2、O2时铜作阳极
12.足量镁粉与一定量的盐酸反应,由于反应速率太快,为减慢反应速率,但并不影响氢气产生的总量,可以加入下列物质中的
A.MgO B.NaOH C.K2CO3 D.CH3COONa
13.两人用同一瓶标准盐酸滴定同一瓶NaOH溶液,甲将锥形瓶用NaOH待测液润洗后,使用水洗过的碱式滴定管取碱液于锥形瓶中,乙则用甲用过的碱式滴定管另取碱液于刚用水洗过且存有蒸馏水珠的锥形瓶中,其他操作及读数全部正确。下列说法正确的是
A.甲操作正确 B.乙操作有误
C.甲测定数值一定比乙小 D.乙实际测得值较准确
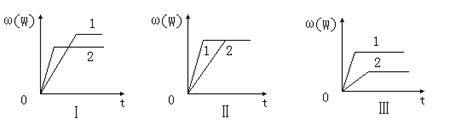 |
14.在一密闭容器中有如下反应:aX(g)+bY(g)
其中,ω(W)表示W在反应混合物中的百分含量,t表示反应时间。其它条件不变时,下列分析可能正确的是
A.图Ⅰ可能是不同压强对反应的影响,且P2>P1,a+b<n
B.图Ⅲ可能是不同温度对反应的影响,且T1>T2,Q<0
C.图Ⅱ可能是不同压强对反应的影响,且P1>P2,n<a+b
D.图Ⅱ可能是在同温同压下催化剂对反应的影响,且1使用的催化剂效果好
15.将质量分数为0.052(5.2%)的NaOH溶液1L(密度为1.06g/cm3)用铂电极电解,当溶液中NaOH的质量分数改变了0.010(1.0%)时停止电解,则此时溶液中应符合的关系是
| NaOH的质量分数 | 阳极析出物的质量/g | 阴极析出物的质量/g | |
| A | 0.062(6.2%) | 19 | 152 |
| B | 0.062(6.2%) | 152 | 19 |
| C | 0.042(4.2%) | 1.2 | 9.4 |
| D | 0.042(4.2%) | 9.4 | 1.2 |
16.下列事实不能用勒夏特列原理解释的是
A.钢铁在潮湿的空气中容易生锈 B.将氯化铝溶液加热蒸干最终得到三氧化二铝固体
C.不考虑其它因素时高压有利于工业合成氨 D.打开汽水瓶时,有大量气泡溢出
17.某温度下,在固定容积的密闭容器中,可逆反应A(g)+3B(g) ![]() 2C(g)达到平衡,测得平衡时A、B、C物质的量之比为n(A):n(B):n(C)=1:1:2,若保持温度不变,以1:1:2的物质的量之比再充入A、B和C,下列判断中正确的是
2C(g)达到平衡,测得平衡时A、B、C物质的量之比为n(A):n(B):n(C)=1:1:2,若保持温度不变,以1:1:2的物质的量之比再充入A、B和C,下列判断中正确的是
A.平衡不移动 B.平衡向逆反应方向移动
C.新平衡时各物质的浓度都比原平衡时增大 D.C的质量分数减小
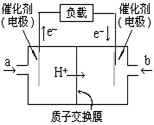 18.如图是2004年批量生产的笔记本电脑所用的甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子。电子经外电路、质子经内电路到达另一极与氧气反应。电池总反应式为:2CH3OH+3O2=2CO2+4H2O。
18.如图是2004年批量生产的笔记本电脑所用的甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子。电子经外电路、质子经内电路到达另一极与氧气反应。电池总反应式为:2CH3OH+3O2=2CO2+4H2O。
下列说法中正确的是
A.右边的电极为电池的负极,b处通入的是空气
B.左边的电极为电池的负极,a处通入的是甲醇
C.电池负极的反应式为:CH3OH+H2O-6e-=CO2+6H+
D.电池的正极反应式为:O2+2H2O+4e-=4OH-
第二卷(非选择题 共76分)
三.(本题包括2小题,共20分)
19.(8分)Ⅰ.下列有关仪器的使用,能实现的是_______________(填序号)
A.用托盘天平称取11.7g食盐 B.用量筒量取12.36ml盐酸
C.用酸式滴定管量取21.20ml 0.10mol/L H2SO4溶液
D.用200ml容量瓶配制500ml 0.1mol/L NaCl溶液
Ⅱ.现用物质的量浓度为a mol/L的标准盐酸去测定V mL NaOH溶液的物质的量浓度,请填写下列空白:
(1)酸式滴定管用蒸馏水洗净后,还应该进行的操作是_______________________。
(2)下图是酸式滴定管中液面在滴定前后的读数:

c (NaOH) = _______________________________________。
(3)若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的NaOH物质的量浓度会偏___________。
20.(12分)Ⅰ.由于条件所限,仅有一大一小两支试管和稀硫酸,甲、乙两同学各找来铝制牙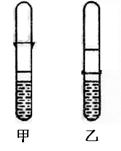 膏皮,各自设计一种装置来制取一试管氢气。他们设计装置如图所示:
膏皮,各自设计一种装置来制取一试管氢气。他们设计装置如图所示:
(1)上述两装置相比,________(填“甲”或“乙”)装置设计
更合理。
(2)用较合理的装置来制取氢气,现欲使氢气充满收集气体的试
管,应采取的措施是__________。
(3)还可以用哪些物品代替牙膏皮或稀硫酸来完成反应?
_______________(填写一种物质即可)。
Ⅱ.为了验证铁与氧气在不同条件下的反应情况,设计如图所示(部分铁架台已略去)的实验,D装置是O2发生装置,A为铁在有水存在下与O2反应装置,B为无锈铁片在加热条件下与O2反应装置,C装置是验证在干燥条件下O2与铁反应装置(C装置事先干燥过)请回答下列问题:
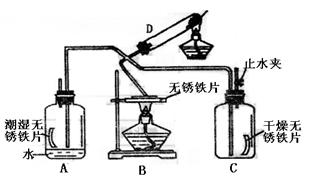
|
(1)为了确保C装置按题干所述条件进行反应,还应在D、C之间加装_______________。
(2)各装置安装及铁片放置完毕后,开始实验,先打开C中的止水夹,其余操作步骤为______________________________________________________。
(3)一段时间后,停止反应,A、B、C中的铁片各有何现象?
________________________________________________________________________。
四.(本题包括2小题,共16分)
21. (6分)
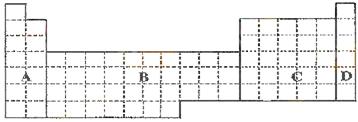
⑴ 在上面元素周期表中全部是金属元素的区域为___________。
(a)A (b)B (c)C (d)D
⑵现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都
生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
甲、乙两元素相比较,金属性较强的是______________(填名称),
可以验证该结论的实验是_____________________________(填编号)。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
22.(10分)Ⅰ.已知pH=2的高碘酸(H5IO6)溶液与pH=12的NaOH溶液等体积混合,所得溶液呈酸性;0.01 mol·L-1的HIO3或HMnO4溶液与pH=12的Ba(OH)2溶液等体积混合所得溶液均呈中性。
(1)H5IO6是 (填“强电解质”或“弱电解质”)。
(2)已知H5IO6和MnSO4在溶液中反应生成高锰酸、碘酸和硫酸,此反应中氧化剂
是 (填化学式)。
Ⅱ.已知某溶液中只存在OH—、H+、NH4+、Cl—四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填写下列空白:
(1)若溶液中只溶解了一种溶质,则该溶质是 ,上述四种离子浓度的大小顺序为 (填序号)。
(2)若上述关系中③是正确的,则溶液中的溶质为 ;若上述关系中④是正确的,则溶液中的溶质为 。
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)
c(NH3·H2O)(填“大于”、“小于”或“等于”,下同),混合前酸中c(H+)和碱中
c(OH-)的关系c(H+) c(OH-)。
五.(本题包括2小题,共22分)
23.(12分)某化学反应2A![]() B+D在四种不同条件下进行B、D起始浓度为零,反应物A的浓度(mol/L),随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行B、D起始浓度为零,反应物A的浓度(mol/L),随反应时间(min)的变化情况如下表:
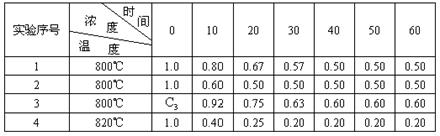
根据上述数据,完成下列填空:
(1)实验1,反应在10至20分钟时间内平均速率为____ __ ,
实验2中还隐含的条件可能是________________ ____;
(2)设反应速率实验3为![]() ,实验1为
,实验1为![]() ,若相同时间内
,若相同时间内![]() >
>![]() ,则c3___1.0mol/L(填>、=、<
,则c3___1.0mol/L(填>、=、<![]() ,理由是____________________
_____;
,理由是____________________
_____;
(3)该反应是________反应(选填吸热、放热),理由是_________________________.
24、(10分)实验室为测定一新配的稀盐酸的准确浓度。通常用纯净的Na2CO3(无水)配成标准溶液进行滴定。具体操作是:称取W克纯净无水Na2CO3装入锥形瓶中,加适量的蒸馏水溶解。在酸式滴定管中加入待测盐酸滴定。
(1)由于CO2溶在溶液中会影响pH,为准确滴定,终点宜选在pH:4—5之间,那么在石蕊、甲基橙、酚酞三种指示剂中应选用 。当滴定至溶液由 色变为 色时,即表示到达终点。
(2)若达到滴定终点时,中和W克Na2CO3消耗盐酸VmL,则盐酸的物质的量的浓度为 mol/L。
(3)若所称取的Na2CO3不纯,则测得盐酸的浓度就不准确。现设盐酸的准确浓度为c1 mol/L,用不纯的Na2CO3标定而测得盐酸浓度为c2 mol/L。在下述情况下,c1与c2的关系是(填“>”或“<”或“=”):
①当Na2CO3中含有NaHCO3时,则c1 c2。
②当Na2CO3中含有NaOH时,则c1 c2。
六.(本题包括2小题,共18分)
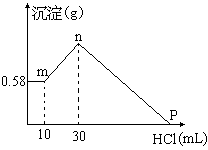 25.(8分)把由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量的水中,有0.58g白色沉淀析出,向所得的浊液里,逐渐加入0.5mol/L的盐酸,加入盐酸的体积和生成沉淀的质量如图所示:
25.(8分)把由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量的水中,有0.58g白色沉淀析出,向所得的浊液里,逐渐加入0.5mol/L的盐酸,加入盐酸的体积和生成沉淀的质量如图所示:
(1)混合物中NaOH的质量是__________________
(g);
AlCl3的质量是__________________ (g);MgCl2的质量是__________________(g)。
(2)P点所表示盐酸加入体积是____________(mL)。
26.(10分)已知可逆反应CO + H2O(g) ![]() CO2 + H2,
CO2 + H2,
达到平衡时,K =![]() ,K是常数,只与温度有关,与浓度无关。
,K是常数,只与温度有关,与浓度无关。
(1)830K时,若起始时:c (CO) = 2 mol/L,c (H2O) = 3 mol/L,平衡时CO的转化
率为60%,水蒸气的转化率为______________;K值为______________。
(2)830K,若只将起始时c (H2O)改为6 mol/L,则水蒸气的转化率为____________。
(3)若830K时,起始浓度c (CO) = a mol/L,c (H2O) = b mol/L,H2的平衡浓度
c (H2) = c mol/L,
①a、b、c之间的关系式是____________________________________;
②当a = b时,a = __________c。
高二期中考试化学试卷 命题:谢 忠
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,全卷满分150分。考试时间120分钟。
第二卷(非选择题 共76分)
三.(本题包括2小题,共20分)
19.(8分)Ⅰ. _______________
Ⅱ. (1)_______________________。(2)____________。(3)__________。
20.(12分)Ⅰ.(1)________
(2)__________________________________________________________。
(3)_______________。
Ⅱ. (1)_______________。
(2)_______________________________________________________________。
(3)_______________________________________________________________。
四.(本题包括2小题,共16分)
21. (6分)⑴ ___________。⑵______________,_____________________________。
22.(10分)Ⅰ.(1) 。(2) 。
Ⅱ. (1) , 。
(2) ; 。
(3) , 。
五.(本题包括2小题,共22分)
23.(12分)(1)____ __ ,_____________ ;
(2)________,理由是____________________ _____;
(3)________,理由是_______________________________________________.
24、(10分)
(1) 。 。
(2) 。
(3)① 。② 。
六.(本题包括2小题,共18分)
25.(8分) (1) _______________ (g);________________ (g); _________________(g)。
(2) ___________________。
26.(10分)(1)______________; ______________。
(2)____________。
(3)①____________________________________; ②__________。
高二期中考试化学试卷参考答案
一、选择题(本题包括8小题,每题4分,共32分。每小题只有一个选项符合题意)
1.C 2.A 3.A 4.D 5.C 6.C 7.C 8.B
二、选择题(本题包括10小题,第9~16小题每小题4分,第17、18小题每小题5分,
共42分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,
该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得
满分,但只要选错一个,该小题就为0分)
9.C 10.D 11.AC 12.D 13.D 14.AD 15.B 16.A 17.C 18.BC
三.(本题包括2小题,共20分)
19.(8分) Ⅰ.__A C_________ (填序号)
Ⅱ.(1)用已知物质的量浓度的标准盐酸润洗2到3次
(2)c (NaOH) = ![]() 。
。
(3)高
20.(12分)Ⅰ.(1)乙
(2)先使反应的试管口伸入收集试管的底部,然后慢慢往下移动(其它合理答案均可) (3)废铁皮、铁钉、食醋等。
Ⅱ.(1)盛浓H2SO4的洗气瓶或装碱石灰的干燥装置。
(2)点燃D处酒精灯片刻,再点燃B处酒精灯。
(3)A中有红褐色锈斑;B中有黑色物质生成;C中无变化。
四.(本题包括2小题,共16分)
21.(6分) (1)___B________ (2) 镁(填名称) b、c (填编号)
22.(10分)Ⅰ.(1)弱电解质 (2)H5IO6
Ⅱ.(1) NH4C1 ①
(2) NH4Cl和NH3·H2O(答NH4Cl和NH3也给分); NH4Cl和HCl
(3) 小于,大于
五.(本题包括2小题,共22分)
23.(12分)(1)0.013 mol·![]() 实验过程中使用了催化剂
实验过程中使用了催化剂
(2)> 浓度越大,反应速率越快
(3)吸热 温度升高时,平衡向右移动 (每空2分)
24.(10分)(1)甲基橙。黄、橙。
(2)1000W/53·V
(3)提示:据Na2CO3——2HCl
106g 2mol
NaHCO3——HCl NaOH——HCl
84g 1mol 40g 1mol
所以等质量时,NaHCO3消耗HCl的体积最少。NaOH消耗HCl的体积最多。
再据c(HCl)![]() ,可知:V(HCl )消耗越多,c(HCl)越小。
,可知:V(HCl )消耗越多,c(HCl)越小。
故①c1 < c2 ②c1 > c2
六.(本题包括2小题,共18分)
25.(8分)⑴2.6g;1.335g;0.95g;
⑵130。
26.(10分)(1) CO + H2O(g)![]() CO2 + H2
CO2 + H2
起始浓度(单位均为mol/L) 2 3 0 0
转化浓度 1.2 1.2 1.2 1.2
平衡浓度 0.8 1.8 1.2 1.2
K=![]()
![]()
(2)设CO的转化浓度为x CO + H2O(g)![]() CO2 + H2
CO2 + H2
起始浓度(单位均为 mol/L) 2 6 0 0
转化浓度 x x x x
平衡浓度 2 – x 6 – x x x
K =![]() ,x = 1.5 mol/L
,x = 1.5 mol/L ![]()
(3) CO + H2O(g)![]() CO2 + H2
CO2 + H2
起始浓度(单位均为mol/L) a b 0 0
转化浓度 c c c c
平衡浓度 a – c b – c c c
①![]() ,②a = b,则a = 2c
,②a = b,则a = 2c