高二化学学业水平测试卷
考试说明:
1.全卷满分为100分,考试时间为75分钟.
2.可能用到的元素的相对原子质量: H-1,C-12,O-16,N-14,Fe-56, Cl-35.5,Na-23
第Ⅰ卷(选择题 共68分)
选择题的答案请填在第II卷的表格中.
一、选择题(本大题包括16小题,每小题3分,共48分。每小题只有一个选项符合题意)
1.胶体区别于其他分散系的本质特征是
A.胶体的分散质能通过滤纸空隙,而浊液的分散质不能
B.产生丁达尔现象
C.分散质粒子直径在1nm~100nm之间
D.胶体在一定条件下能稳定存在
2.下列关于硫及含硫化合物的叙述正确的是
A.SO2的漂白原理与次氯酸相同
B.硫在空气中燃烧生成大量SO3
C.浓硫酸可以干燥H2、NH3、CO2等气体
D.常温下铝遇浓硫酸钝化,因此可用铝槽储运浓硫酸
3.用NA表示阿伏加德罗常数,下列叙述正确的是
A.标准状况下,22.4LH2O含有的水分子数为NA
B.常温常压下,0.62g Na2O含有的Na+离子数为0.02 NA
C.通常状况下,11.2LCO2的分子数为0.5NA
D.物质的量浓度为0.5mol·L-1的MgCl2溶液中,含有Cl-个数为NA
4.某无色溶液在滴加石蕊试液时呈红色,在此溶液中能大量共存的离子组是
A.K+ 、MnO4-、Na+、Cl- B.K+、Na+、NO3-、CO32-
C.Na+、H+、Cl-、SO42- D.NH4+、Na+、Cl-、HCO3-
5.下列离子方程式中,书写正确的是
A.电解饱和食盐水 2Cl—+2H+![]() H2↑+C12↑
H2↑+C12↑
B.氯气与溴化钾溶液反应:Cl2+2Br-=2Cl-+Br2
C.稀硫酸与氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓
D.实验室用大理石和稀盐酸制取CO2:2H+ + CO32- = CO2↑+ H2O
6.NO2被水吸收的过程中,发生了氧化还原反应3NO2+H2O=2HNO3+NO,其中被氧化的N原子和被还原的N原子,其物质的量之比是
A.3:1 B.1:3 C.1:2 D.2:1
7.下列电子式中错误的是
![]()
![]() D.
D.![]()
8.14C是一种放射性同位素,在高层大气中由宇宙射线产生的中子或核爆炸产生的中子轰击14N可使它转变为14C。下列说法正确的是
A.14C和14N互为同位素 B.14C和C60是同素异形体
C.146C核素中的中子数为8 D.14CO2的摩尔质量为46
9.下列各组中化合物的性质比较,不正确的是
A.酸性:HClO4>HBrO4>HIO4 B.碱性:NaOH>Mg(OH)2>Al(OH)3
C.稳定性:PH3>H2S> HCl D.非金属性:F>O>S
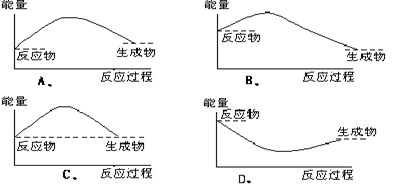 |
10.下列各图中,表示正反应是吸热反应的图是
11.反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率ν(X)(反应物的消耗速率或产物的生成速率)可表示为
4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率ν(X)(反应物的消耗速率或产物的生成速率)可表示为
A.ν(NH3)=0.010mol/L·S B.ν(O2)=0.0010mol/L·S
C.ν(NO)==0.0010mol/L·S D.ν(H2O)=0.045mol/L·S
12.有NaCl、KSCN、NaOH、AgNO3四种溶液,只用一种试剂就把它们鉴别开来,这种试剂是
A.盐酸 B.Na2CO3溶液 C.氯水 D.FeCl3溶液
13.在下列有关实验的叙述中,正确的是
A.用烧杯或烧瓶给液态物质加热时,不用垫石棉网
B.实验室中加热NH4Cl和Ca(OH)2的固体混合物制取氨气
C.在用托盘天平称量固体药品时,药品直接放在右盘上
D.提取碘水中的碘:加入适量乙醇,振荡、静置、分液
14.下列关于有机物的说法正确的是
A.甲烷易发生加成反应 B.常温下乙烯易发生取代反应
C.油脂是高分子化合物 D.烃是指仅含有碳和氢两种元素的有机物
15.生物质能是绿色植物通过叶绿素将太阳能固化为化学能而贮存在生物质内部的能量。一直是人类赖以生存的重要能源,江苏是全国以试验性利用生物质能最多的省份。下列有关说法不正确的是
A.农村通过杂草和动物的粪便发酵制沼气,沼气的主要成分是甲烷
B.苏北五市推广使用乙醇汽油,乙醇可由富含淀粉的谷物发酵产生
C.用油料作物生产的生物柴油成分与从石油中提取的柴油成分相同
D.开发生物质能有利于环境保护和经济可持续发展
16.下列叙述不正确的是
A.用银氨溶液检验某病人是否患糖尿病
B.为了防止Fe2+被氧化,可在盛FeSO4溶液的试剂瓶中加少量铁粉
C.在鸡蛋白溶液中滴入浓HNO3,微热会产生黄色物质
D.酶不属于蛋白质
二、选择题(本大题包括5小题,每小题4分,共20分。每小题只有一个选项符合题意)
17.国际互联网上报道:“目前世界上有近20亿人患有缺铁性贫血”.我国政府现已启动“酱油补铁工程”.这里的铁指的是
A.铁元素 B.铁单质 C.四氧化三铁 D.硫酸铁
18.下列有关维生素C的说法中正确的是
A.维生素C难溶于水 B.食品中添加维生素C不利于身体健康
C.维生素C能使酸性高锰酸钾溶液褪色 D.含维生素C的食物宜在高温下烹调
19.食品卫生与身体健康关系密切,下列做法都会导致食品对人体有害的是:①在食盐中加入适量碘酸钾防治碘缺乏症 ②用工业酒精兑制饮用酒以降低成本③用活性炭来脱色以制白糖 ④加工香肠时加入亚硝酸钠以保持肉类新鲜 ⑤做馒头时加入适量纯碱或碳酸氢钠使馒头松软:
A.②和④ B.①和③ C.③和⑤ D.②和⑤
20.随着化学工业的发展,各种化学合成材料已走进我们寻常百姓家,下列关于生活中常用
材料的认识,正确的是
A.尼龙、羊毛和棉花都是天然纤维
B.现在生产的各种塑料在自然条件下都不可降解
C.由酚醛树脂制成的插座破裂后可以热修补
D.装食品用的聚乙烯塑料袋可以通过加热进行封口
21.材料是人类赖以生存的重要物质基础,而化学是材料科学发展的基础。下列有关材料的说法中正确是
A.生活中的玻璃、陶瓷、水泥属于无机硅酸盐材料,其生产原料都需要使用石灰石
B.合金材料钢铁里的铁和碳在潮湿的空气中因构成许多原电池而易发生电化学腐蚀
C.三大合成材料是指合成塑料、合成纤维和黏合剂
D.造成“白色污染”的聚氯乙烯塑料在日常生活中可用来进行食品包装
第Ⅱ卷(非选择题 共32分)
请将选择题的答案填在下表中.
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 答案 | |||||||||||
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | |
| 答案 |
三、(本题包括5小题,共26分)
22.(8分)⑴下表是某食品包装袋上的说明,从表中的配料中分别选出一种物质填在相应的横线上
| 品 名 | ××× |
| 配 料 | 鲜鸡蛋、精面粉、白砂糖、精炼植物油、奶油、奶粉、食盐、柠檬汁等 |
| 保 质 期 | 240天 |
| 生产日期 | 标于包装袋封口上 |
①富含蛋白质的物质是_________________;②富含糖类的物质是__________________;
③富含油脂的物质是___________________;④富含维生素的物质是________________。
⑵阅读下列材料后回答问题:
一个体重50kg的健康人,体内约含有2g铁,这2g铁在人体内不是以单质的形式存在,而是以Fe2+ 和Fe3+的形式存在.正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收。
|
① 在人体中进行Fe2+![]() Fe3+的转化时,①中的Fe2+作 ____ 剂,②中的Fe3+作 _____ 剂;
Fe3+的转化时,①中的Fe2+作 ____ 剂,②中的Fe3+作 _____ 剂;
②“服用维生素C,可使食物中的Fe3+ 还原成Fe2+”这句话指出,维生素C在这一反应中作____ 剂
③市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐。此反应的化学方程式为 。
23.(4分)现有下列四种物质 A.食盐 B.食醋 C.青霉素 D.葡萄糖 ,请按下列要求填空(填序号)。
既可作为调味剂,又可作为防腐剂的是 _ ;可直接进入血液,补充能量的是 ;应用最广泛的抗生素之一的是 ;食用过多会引起血压升高、肾脏受损的 。
24.(3分)欲用18 mol/L的浓硫酸(密度为1.84g/mL)配制成浓度为 0.5mol/L 的稀硫酸 500mL。
(1)计算: 所需浓硫酸的体积为________mL
(2)选用的主要仪器有:烧杯、量筒、胶头滴管、玻璃棒和_____________ 。
(3)请将下列各操作按正确的序号填写在横线上________________________。
A.用量筒量取浓硫酸 B.反复颠倒摇匀
C.用胶头滴管加水至刻度 D.将配制好的溶液转入试剂瓶中贴上标签
E.稀释浓硫酸 F.将溶液转入容量瓶
25.(7分)为了探究HClO的漂白性,某同学设计了如下的实验。
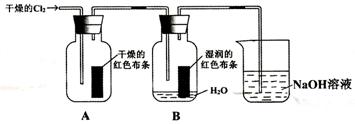
(1)通入Cl2后,从集气瓶A中干燥的红色布条的现象可得出的结论是 ____
从集气瓶B中湿润的红色布条的现象可得出的结论是 __________________
其中发生的反应是
(2)为了确证是HClO起漂白作用,你认为还应增加的实验是 ___
烧杯中发生反应的化学方程式是 ________________________________ 。
26.(4分)有机物A的分子式为C4H8O2,A在酸性条件下与水反应,生成分子内均含有2个碳原子的有机物B和C;B在加热和铜催化下被氧化为D, D能发生银镜反应.
请回答下列问题:
(1)写出A和D的结构简式:A、 ___________ D、
(2)写出下列反应的化学方程式:
B与C反应:
.
四、计算题(共6分)
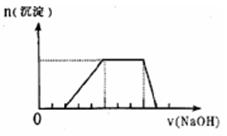
27.(6分)某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42+ 等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是___________________________,且各离子的物质的量之比为___________________;肯定不含的阳离子是____________________。
答案:
1-21
CDBCBDDCCACDBDCDACADB
22.鲜鸡蛋、奶油、奶粉 精面粉、白砂糖
精炼植物油 柠檬汁
① 还原剂 氧化剂
② 还原剂
③ Fe+2H+=Fe2++H2↑
23.AB D C A
24、(1) 13.9ml (1分)
(2) 500ml容量瓶 (1分)
(3)AEFCBD__ 1分)
25. (8分)为了探究HCiO的漂白性,某同学设计了如下的实验。
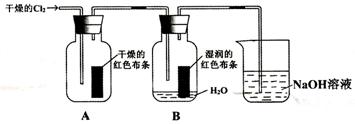
(1)通入Cl2后,从集气瓶A中干燥的红色布条的现象可得出的结论是
干燥的氯气没有漂白性
从集气瓶B中湿润的红色布条的现象可得出的结论是 HClO具有漂白性
其中发生的反应是 Cl2+H2O ==HCl+HClO
(2)为了确证是HClO起漂白作用,你认为还应增加的实验是稀盐酸是否能使有色布条褪色
烧杯中发生反应的化学方程式是 Cl2+2NaOH==NaCl+NaClO+H2O 。
26.CH3COOCH2CH3 CH3CHO
CH3CH2OH+CH3COOH→CH3COOCH2CH3+H2O
27.(6分)
H+、NH4+、Al3+ (2分) 2:3:1 (2分) Fe3+ 、Mg2+ (2分)