高二化学学业水平测试最后一练
化学试题
考试时间75分钟,满分100分。
第一卷(选择题 共69分)
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Cl 35.5 K 39
一、选择题(本题包括17小题,所有考生均须作答!每小题3分,共51分。每小题只有一个选项符合题意。)
1.氢氧化铁胶体稳定存在的主要原因是 ( )
A.胶粒带正电荷 B.胶粒作布朗运动
C.胶粒直径小于lnm D.胶粒不能通过半透膜
2.将C mol·L-1的AlCl3溶液V1 mL加水稀释至V2mL,稀释后溶液中Cl-物质的量浓度为( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
3.配制100 mL 1.0 mol·L-1Na2CO3溶液,下列操作正确的是 ( )
A.称取28.6 g Na2CO3.10H2O,加入100 mL容量瓶中,加水溶解、定容
B.称取 28.6 g Na2CO3.10H2O,加入100 mL蒸馏水,搅拌、溶解
C.转移时将烧杯中溶液直接倒人容量瓶中
D.定容后,塞好瓶塞,反复倒转、摇匀
4.14C是一种放射性同位素,在高层大气中由宇宙射线产生的中子或核爆炸产生的中子轰击14N可使它转变为14C。下列说法正确的是( )
A.14C和14N互为同位素 B.14C和C60是同素异形体
C.146C核素中的中子数为8 D.14CO2的摩尔质量为46
5.如果要除去Na2CO3 固体中少量的NaHCO3,则应选择的最佳方法是 ( )
A.加入适量盐酸 B.加入NaOH溶液
C.加热灼烧 D.配成溶液后通入CO2
6.下列关于实验操作的叙述中正确的是( )
A.从试剂瓶中取出任何药品,若有剩余一定不能再放回原试剂瓶中
B.可燃性气体点燃之前必须验纯
C.用胶头滴管向试管中滴加液体,一定要将滴管伸入试管内
D.用温度计搅拌溶液一定要慢慢搅拌
7.下列实验方案能达到目的的是( )
A.除去NaCl固体中混有的MgCl2:加入KOH试剂后过滤
B.实验室获取少量纯净的水:蒸馏自来水
C.提纯混有少量硝酸钾的氯化钾:将混合物溶于热水中,再冷却、结晶并过滤
D.提取碘水中的碘:加入适量乙醇,振荡、静置、分液
8.下列各组物质的性质比较,正确的是( )
A.酸性:HClO4>H3PO4>H2SO4 B.氢化物稳定性:H2S>HF>H2O
C.碱性:NaOH>Mg(OH)2>Ca(OH)2 D.氧化性:F2 > Cl2 > Br2 > I2
9.下列离子方程式书写不正确的是( )
A.常温下氯气与烧碱溶液反应:Cl2 + 2OH - ══ Cl- + ClO- + H2O
B.AlCl3溶液中加入足量的氨水:Al3++ 3NH3·H2O ══ Al(OH)3↓+3NH4+
C.铜与稀硝酸反应:Cu + 2H+ ══ Cu2+ + H2↑
D.FeCl3溶液中加入KSCN:Fe3++3SCN一══Fe(SCN)3
10.已知,有机化合物A只由C、H两种元素组成且能使溴水褪色,其产量可以用来衡量一个国家石油化工发展水平。A、B、C、D、E有如下关系:

则下列推断不正确的是( )
A.鉴别A和甲烷可选择使用酸性高锰酸钾溶液
B.D中含有的官能团为羧基,利用D物质可以清除水壶中的水垢
C.物质C的结构简式为CH3CHO,E的名称为乙酸乙酯
D.B+D→E的化学方程式为:CH3CH2OH+CH3COOH→CH3COOC2H5
11.某元素的微粒37X-的核外电子数为18,则该元素原子的中子数是 ( )
A.17 B.18 C.19 D.20
12.实验要知其所以然。将铜片和锌片用导线连接后插入番茄里,如下图所示,电流计指针发生偏转,锌片是( )
A.电子流入的一极 B.正极
C.发生还原反应的一极 D.负极
13.为了使江苏的天更蓝,空气更清新,目前我省某些城市对没有申领到“绿色”通行证的高污染车实行限行。高污染车排出的尾气中所含的污染物除碳氢化合物、可吸入颗粒物、一氧化碳外,还主要含有( )
A.二氧化碳 B.氮氧化物 C.水蒸气 D.氮气
14.下列溶液的溶质都是强电解质,这些溶液中的C1—的物质的量浓度与150mL lmol·L-1CaCl2溶液中的Cl—物质的量浓度相等的是( )
A.150 mL 1 mo1.L-l NaCl溶液 B.75 mL 2 mol·L—1MgCl2溶液
C.150 mL 2 mo1.L—1KCl溶液 D.75 mL 1 mol·L-1A1C13溶液
15.实验室用铜和浓硫酸反应制取二氧化硫,下列有关该反应的说法错误的是( )
A.铜是还原剂,发生了氧化反应
B.每生成64 g SO2,转移电子的物质的量是2 mol
C.每消耗1 mol Cu,起氧化剂作用的硫酸消耗2 mol
D.在此反应中,浓硫酸表现出酸性和氧化性
16.把下列四种X溶液分别加入四个盛有l0mL 2mol/L硫酸的烧杯中,发生反应,其中反应速率最大的是( )
A.10mL 0.5mol/L的X溶液 B.10mL lmol/L的X溶液
C.l0mL 1.5mol/L的X溶液 D.10mL 2mol/L的X溶液
17.实验室用乙酸、乙醇、浓H2SO4制取乙酸乙酯,加热蒸馏后,在饱和Na2CO3溶液的液面上得到无色油状液体,当振荡混合物时,有气泡产生,主要原因可能是( )
A.有部分H2SO4,被蒸馏出来了
B.有部分未反应的乙醇被蒸馏出来了
C.有部分未反应的乙酸被蒸馏出来了
D.有部分乙酸乙酯与碳酸钠反应了
二、选择题(本题分A、B两组试题,每组试题包括6小题,每个考生只要选择其中一组试题作答。建议选修《化学与生活》的考生选做A组题,选修《有机化学基础》的考生选做B组题!若两组试题均作答,则以A组题判分。每小题3分,共18分。每小题只有一个选项符合题意。)
A组题(建议选修《化学与生活》的考生选做该组试题)
18.铝在人体中积累可使人慢性中毒,1989年世界卫生组织正式将铝“确定为食品污染之一”而加以控制。铝在下列场合须加以控制的是 ( )
①制铝锭 ②制易拉罐 ③制电线电缆 ④制牙膏皮 ⑤用明矾净水 ⑥制炊具 ⑦用明矾和小苏打作出食物膨化剂 ⑧用Al(OH)3制成胃药 ⑨制防锈油漆
A.①②④⑤⑥⑦
B.②⑤⑥⑦⑧⑨
C.②④⑤⑥⑦⑧
D.③④⑤⑥⑦⑧
19.下面的几种食谱中,你认为营养不均衡的是 ( )
A.凉拌西红柿、白菜、豆腐、炖肉、米饭
B.排骨炖面筋、馒头、香菇、萝卜汤、虾皮炒油菜
C.酱牛肉、面包、果汁、生菜卷、玉米沙拉
D.凉拌芹菜、海米、豆腐汤、肉丁炸酱、西红柿炒鸡蛋
20.明矾净水的作用是 ( )
A.除去水中氯离子 B.除去水中钙离子
C.除去水中悬浮物 D.消毒杀菌
21.材料是人类赖以生存的重要物质基础,而化学是材料科学发展的基础。下列有关材料的说法中正确是( )
A.生活中的玻璃、陶瓷、水泥属于无机硅酸盐材料,其生产原料都需要使用石灰石
B.合金材料钢铁里的铁和碳在潮湿的空气中因构成许多原电池而易发生电化学腐蚀
C.居室装修材料如化纤地毯、三合板、花岗岩等均会释放出污染空气的甲醛气体
D.造成“白色污染”的聚氯乙烯塑料在日常生活中可用来进行食品包装
22.从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平。下图表示了三种金属被人类开发利用的大致年限,之所以有先后,主要取决于 ( )
 | 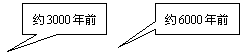 | ||
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
A.金属的导电性强弱 B.金属在地壳中的含量多少
C.金属的化合价高低 D.金属的活动性大小
23.目前已有包括我国在内的多个国家试制无冷却式陶瓷发动机汽车,使热效率大幅度提高。可用作制造这种发动机的耐高温材料是( )
A.氮化硅陶瓷 B.水泥 C.光导纤维 D.玻璃钢
B组题(建议选修《有机化学基础》的考生选做该组试题)
18.制备一氯乙烷最好采用的方法是 ( )
A.乙烷与氯气反应 B.乙烯与氯气反应
C.乙烯与氯化氢反应 D.乙炔与氯化氢反应
19.将硬脂酸甘油酯和氢氧化钠溶液共热进行皂化反应,能把硬脂酸钠和甘油从混合溶液中分离出来的方法是:①盐析 ②过滤 ③蒸馏 ④分液 ⑤结晶。其中正确的组合是( )
A.①②③ B.①③④⑤ C.②③④ D.①②④⑤
20.下列各组物质,分别取等物质的量在足量氧气中完全燃烧,耗氧量不同的是( )
A. 乙烷和甲酸乙酯
B. 乙炔和乙醛
C. 乙烯和乙醇 D.乙醇和乙酸
21.下列实验能成功的是( )
A. 苯与浓溴水反应(Fe作催化剂)制溴苯
B. 福尔马林与苯酚的混合物,沸水浴加热制酚醛树脂
C. 氯乙烯加聚的生成物能使酸性KMnO4溶液褪色
D. 加热硫酸、乙醇、氯化钠固体的混合物制氯乙烷
22.能在有机物分子中引入羟基的反应类型有:
①酯化;②取代;③消去;④加成;⑤水解;⑥氧化。其中正确的组合是( )
A.①②③⑥ B.④⑤ C.②④⑤⑥ D.②④⑥
23.某有机物ng,跟足量金属钠反应生成vLH2,另取ng该有机物与足量碳酸氢钠作用生成vLCO2(同一状况),该有机物分子中含有的官能团为( )
A.含一个羧基和一个羟基 B.含两个羧基
C.只含一个羧基 D.含两个羟基
第二卷(非选择题 共31分)
三、(本题分A、B两组试题,每组试题包括2小题,每个考生只要选择其中一组试题作答。建议选修《化学与生活》的考生选做A组题,选修《有机化学基础》的考生选做B组题!若两组试题均作答,则以A组题判分。共10分。)
A组题(建议选修《化学与生活》的考生选做该组试题)
24.(6分)填空
⑴糖尿病患者的血液和尿液中含有过量的 (写化学式);
⑵油脂的水解产物是高级脂肪酸和 ;
⑶加入饱和Na2SO4可使蛋白质发生 ;
⑷人体缺乏维生素C会得 病;
⑸钢铁露置于潮湿的空气中,会发生 腐蚀,其负极发生的电极反应为 。
25.(4分)某生活污水有一股臭味,主要含有碎菜叶、碎塑料薄膜、泥沙、氯化钠和碳酸钠等物质。现欲将其经去渣、除臭处理后用作清洗厕所的用水,问:
⑴采用何种操作,可除去污水中的碎菜叶,碎塑料薄膜及泥沙?
⑵用什么物质可除去污水中的臭味?
⑶把生活污水进行处理再利用的目的是什么?
⑷怎样检验⑴和⑵处理后的水中是否存在氯离子?
B组题(建议选修《有机化学基础》的考生选做该组试题)
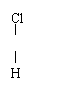
24.(4分)下列各组微粒或物质:
![]() A.O2和O3 B.
A.O2和O3 B.![]() C和
C和![]() C C.CH3CH2CH2CH3和CH3CH2 CHCH3
C C.CH3CH2CH2CH3和CH3CH2 CHCH3
D.Cl-C-Cl和Cl-C-H E.CH3CH2CH2CH3和CH3-CH-CH3
(1) 组两种物质互为同位素;(2) 组两种物质互为同素异形体;
(3) 组两种物质属于同系物;(4) 组两种物质互为同分异构体。
25.(6分)A、B、C、D四种有机物,在一定条件下有如下转化关系:
![]()
已知D的化学式为![]() ,则:
,则:
(1)A、C的结构简式:A C
(2)写出化学方程式:
![]() A B:
A B:
![]() C D:
C D:
四、(本题包括4小题,所有考生均须作答!共21分。)
26.(9分)①②③④⑤五种元素,在元素周期表中的位置如图所示。回答下列问题:
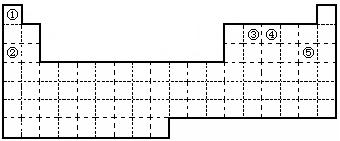
(1)上述五种元素中,金属性最强的元素在周期表中的位置是 ,
该元素的单质在空气中燃烧的化学方程式为 。
(2)元素①和③可以形成众多的化合物,其中最简单的是(写化学式) ,
该化合物中,化学键的类型为 (填“离子键”或“共价键”)。
(3)试用单线桥法表示元素④最高氧化物的水化物与Cu反应过程中电子转移的数目和方向 ,该反应中作氧化剂的是(写化学式) 。
(4)试用电子式表示元素⑤单质分子的形成过程 。
27.(7分)在下列中学化学中常见物质的转化关系图中,已知常温下A为淡黄色固体、B为金属单质,D、E、M是常见气体单质,其中M为黄绿色,N是胃酸的主要成分,工业上用E和M来制取N,试推断:
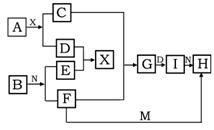
(1)写出下列化学式 A I
(2)G转化为I的现象为
(3)F+M→H离子方程式为
(4)A+X→C+D的化学方程式为_______________________________
28.(5分)铁粉和氧化亚铁粉末的混合物共9.2克,加入到150毫升的稀硫酸中,恰好完全反应,得到氢气2.24升(标准状况)。求:
(1)混合物中铁和氧化亚铁的质量。
(2)原稀硫酸的物质的量浓度。
化学参考答案
一、选择题(51分)
1.A 2.D 3.D 4.C 5.C 6.B 7.B 8.D 9.C 10.D
11.D 12.D 13.B 14.C 15.C 16.D 17.C
二、选择题(18分)
A组18.C 19.B 20.C 21.B 22.D 23.A
B组18.C 19.A 20.D 21.D 22.C 23.A
三、(10分)
A组
24.(6分)C6H12O6 甘油 盐析 坏血 电化学 Fe-2e-=Fe2+
25.(4分)
⑴沉降、过滤
⑵活性炭、木炭、吸附剂、除臭剂、微生物作用(答对一种即可)
⑶节约用水
⑷取少量待测液于试管中,滴加AgNO3溶液,若有白色沉淀生成,加稀HNO3白色沉淀不消失,则证明含Cl-。(先加稀HNO3,再加AgNO3亦可)
B组
24.(4分)⑴B ⑵A ⑶C ⑷E
25.(6分)(1)A:CH3CH2OH B:CH3COOH
(2) ![]()
![]()
四、(21分)
26.(9分)(1)第三周期第IA族 (2)CH4 共价键 (3)方程式略 HNO3(4)略
27.(7分)(1)Na2O2 Fe(OH)3
(2)白色沉淀变为灰绿色,最后变为红褐色
(3)2Fe2+Cl2=2 Fe3+ +2Cl—
(4) 2Na2O2+2H2O=4NaOH+O2↑
28.(5分)(1)Fe 5.6g FeO 3.6g (2)1mol/L