高二化学学业水平调研题
考试时间:75分钟; 总分:100分
命题人:石武贤 07.3
解题可能用到的相对原子质量
H:1 C:12 N:14 O:16 Cl:35.5 Mn:55 S:32 Ba:137
第 I卷 选择题(共69分)
一、选择题(每小题只有一个正确答案。)
1、下列物质中,属于电解质的是 ( A )
A、铁 B、H2SO4 C、蔗糖 D、酒精
2、在配制2.0mol/L NaCl溶液的实验中,必须使用的仪器是 ( A )
![]()
![]()
![]()
![]()
A B C D
3、鉴别FeCl3溶液和Fe(OH)3胶体,下列方法中最简单有效的是 ( D )
A.加入足量的NaOH溶液 B.加热煮沸
C.加入足量的盐酸 D.观察是否产生丁达尔现象(效应)
4、医院里检查患者是否患有糖尿病,是检测其尿液中的 ( D )
A.脂肪 B.食盐 C.蛋白质 D.葡萄糖
5、下列物质属于合成高分子材料的是 ( B )
A.水泥 B.食品保鲜膜 C.钛合金 D.陶瓷
6、酒精燃烧的过程中,发生了能量的转化。下列判断中正确的是 ( A )A.化学能部分转化为热能 B.电能部分转化为化学能
C.热能部分转化为化学能 D.光能部分转化为化学能
7、下列有关环境问题都是由化学物质引起的,在下列组合中对应的化合物不正确的是(C )
A.温室效应:二氧化碳 B.光化学烟雾:二氧化氮
C.酸雨:二氧化碳 D.臭氧层破坏:氟氯烃
8、有关化学用语正确的是
(D )
A.乙烯的最简式C2H4 B.乙醇的结构简式C2H6O
C.四氯化碳的电子式![]() D.臭氧的分子式O3
D.臭氧的分子式O3
9、关于化学键的下列叙述中,正确的是
( A )
A.离子化合物可能含共价键 B.共价化合物可能含离子键
C.离子化合物中只含离子键 D.离子化合物中一定含有金属离子
10、下列反应中,盐酸既表现出酸性又表现出还原性的是
( A )
A.MnO2 + 4HCl(浓)![]() MnCl2 + Cl2↑+ 2H2O B.HCl + AgNO3 =AgCl↓+ HNO3
MnCl2 + Cl2↑+ 2H2O B.HCl + AgNO3 =AgCl↓+ HNO3
C.Zn + 2HCl = ZnCl2
+ H2↑ D.2HCl ![]() H2↑+
Cl2↑
H2↑+
Cl2↑
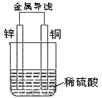
11、下列关于右图所示装置的叙述,正确的是 (D )
|
|
A.铜是负极,铜片上有气泡产生 B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片 D.氢离子在铜片表面被还原
12、下列反应中,属于加成反应的是( B)
A.CH3Cl+Cl2→CH2Cl2+HCl B.CH2=CH2+HClO→HOCH2—CH2Cl
C.SO2+2NaOH→Na2SO3+H2O D.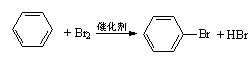
13、在强酸性溶液中,可以大量共存的离子是 ( B )
A.K+、Na+、SO42-、CO32- B.NH4+、Mg2+、SO42-、Cl-
C.Na+、K+、HCO3-、Cl- D.K+、Na+、AlO2-、NO3-
14、同周期的X、Y、Z三种元素,其最高价氧化物对应的水化物的酸性由弱到强的顺序是: H3Z04<H2Y04<HX04则下列判断正确的是( A)
A、非金属性 X>Y>Z B、原子半径X>Y>Z
C、原子的最外层电子数按X、Y、Z的顺序由少到多
D、气态氢化物的稳定性按X、Y、Z的顺序由弱到强:
15、设NA表示阿伏加德罗常数,下列叙述中正确的是(A )
A.常温常压下,48gO3含有的氧原子数为3NA
B.1.8g的NH4+ 离子中含有的电子数为0.1NA
C.常温常压下,11.2 L氧气所含的原子数为NA
D.2.4g金属镁变为镁离子时失去的电子数为0.1NA
16、对于某些离子的检验及结论一定正确的是(C )
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32-
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42-
C.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
17、下列反应的离子方程式书写正确的是( C)
A、金属铝溶于氢氧化钠溶液Al+20H-=AlO2-+H2↑ .
B、钠和水反应 Na+2H20=Na++20H-+H2↑
C、金属铝溶于稀硫酸中:2Al+6H+=2A13++3H2↑
D、铜粉加入FeCl3溶液中:Cu+Fe3+= Fe2++Cu2+
18、下列变化过程中,没有破坏化学键的是( C )
A.氯化钠的融化 B.碳的燃烧 C.氮气溶于水 D.水的通电分解
19、下列各组物质中,互为同位素的是 ( C )
A、红磷与白磷 B、正丁烷与异丁烷
C、11H与21H D、金刚石与C60
20、一定温度下,某一密闭恒容的容器内可逆反应A(g) + 3B(g) === 2C(g)达到平衡状态的标志是 (A )
A、C的生成速率与C的分解速率相等
B、容器内混合气体的密度不随时间而变化
C、单位时间内生成n mol A,同时生成3n mol B
D、A、B、C的分子数之比为1:3:2
21、下列各物质组中,所含两种物质化学键类型不同的是 ( C )
A、HCl和NH3 B、CaCl2和NaCl C、H202和Na202 D、NaS04和NaOH
22、将钠、镁、铝各0.3mol分别放入 足量盐酸中,同温同压下产生气体的体积比是(A )
A、1:2:3 B、6:3:2 C、3:1:1 D、1:1:1
23、为了验证碳酸氢钠固体中是否含有碳酸钠。下列实验及判断中,正确的是(C )
A、加热,观察是否有气体放出 B、溶于水后加石灰水,看有无沉淀
C、溶于水后加氯化钡溶液,看有无沉淀 D、加热后称量,看质量是否变化
第Ⅱ卷(非选择题 共31分)
注意:请将I卷的选择题的答案用2B铅笔图写在答题纸上。
二、填空题:
24、(4分)欲用18 mol/L的浓硫酸(密度为1.84g/mL)配制成浓度为 0.5mol/L 的稀硫酸 500mL。
(1)选用的主要仪器有:烧杯、量筒、胶头滴管、玻璃棒和_________
。
(2)请将下列各操作按正确的序号填写在横线上__________。
A.用量筒量取浓硫酸 B.反复颠倒摇匀
C.用胶头滴管加水至刻度 D.将配制好的溶液转入试剂瓶中贴上标签
E.稀释浓硫酸 F.将溶液转入容量瓶
(3)简要回答下列问题:
①所需浓硫酸的体积为______mL;
②如果实验室有15mL 、20mL、50mL的量筒,应选用_____mL。
25、(9分)①②③④⑤五种元素,在元素周期表中的位置如图所示。回答下列问题:
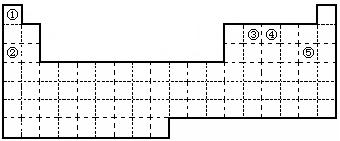
(1)①②③④⑤五种元素中,金属性最强的元素位置是 ,
该元素的单质在空气中燃烧的化学方程式为 。
(2)元素①和③可以形成众多的化合物,其中最简单的是(写化学式) ,
该化合物中,化学键的类型为 (填“离子键”或“共价键”)。
(3)画出元素④的原子结构示意图 ,该元素的最高氧化物的水化物能与Cu发生反应,反应中作氧化剂的是(写化学式) 。
(4)写出元素⑤单质分子的电子式 ,其单质在常温下为黄绿色的气体,实验中可以用NaOH溶液吸收,反应的离子方程式为 。
26、(4)分子式为C4H10 的烃的所有的结构简式为
用系统命名法给予命名
27、(8分)在试管甲中加入3 mL 乙醇,然后边振荡试管边慢慢加入2 mL 浓硫酸和2 mL 乙酸,按下图所示连接好装置进行实验,以制取乙酸乙酯。
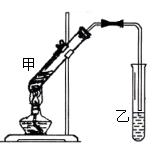 (1) 试管乙中盛放的溶液是_________________。
(1) 试管乙中盛放的溶液是_________________。
(2) 写出乙醇与乙酸反应的化学方程式__________________________________。
(3)实验完成后,试管乙的液面上有透明的不溶于水的油状液体产生。若分离10 mL该液体混合物需要用到的玻璃仪器是____________,这种方法叫做__________。
(4)实验室可用乙醇来制取乙烯,将生成的乙烯通入溴的四氯化碳溶液,反应后生成物的结构简式是_________________。
三、计算题
28、(6)将10.7g氯化铵固体与足量熟石灰混合加热,使之充分反应。试计算:
(1)生成的氨气在标准状况下的体积是多少升?
(2)若将这些氨气配成500mL氨水,该氨水的物质的量浓度是多少?
第二卷部分参考答案
24、(1) 500ml容量瓶 (1分)
(2) AEFCBD (1分)
(3)① __13.6 __ _ (1分)
② __15
_ (1分)
26、(2)丁烷 2-甲基丙烷
27、 (1)饱和碳酸钠溶液 (2)CH3COOH + CH3CH2OH CH3COOCH2CH3 +H2O
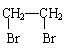 |
(3)分液漏斗 萃取 (4) (每小题2分,共8分)
28、(1)4.48L (2)0.4mol/L