高二化学自测试题
命题:袁开荣
本试卷满分100分,考试时间90分钟
可能用到的相对原子质量:C-12,O-16,Na—23,Cl—35.5,
S—32,H—1 Fe—56 Cu-64
第I卷(非选择题共54分)
一、选择题(每题只有一个选项符合题意,每小题3分)
1.法新社2006年4月4日报道,天文学家在太空中发现一个长4630亿千米的甲醇气团,这一天文发现为揭示“原始气体如何形成巨大恒星”提供了有力依据。下列有关甲醇的说法正确的是( )
A.甲醇能使蛋白质变性 B.甲醇能发生消去反应
C.甲醇不能被催化氧化 D.甲醇与钠反应比水与钠反应剧烈
2.最近医学界通过用14C标记的C60发现一种C60的羟酸衍生物,在特定条件下可以通过断裂DNA抑制艾滋病毒的繁殖,则有关14C的正确叙述是( )
A.与12C60的碳原子化学性质不同
B.与14N含的中子数相同
C.是12C60的同素异形体
D.与12C、13C互为同位素
3.下列叙述中,正确的是 ( )
A.淀粉、纤维素互为同分异构体,都属于糖类;硝酸纤维、醋酸纤维都属于酯类
B.骨胶、皮胶以及日常生活中常用的糨糊、胶水都是黏合剂
C.相对分子质量相同、组成元素也相同,但分子结构不同、性质也不同的两种有机物一定是同分异构体
D.由一个有机物分子在一定条件下反应生成一个新的有机物分子和一个无机物分子的反应一定是消去反应
4..下列说法中正确的是(NA表示阿伏加德罗常数) ( )
A.273℃、1.01×105 Pa下,NA个H2分子所占体积约为22.4 L
B.2.3 g金属钠变成离子时失去的电子数目为NA
C.1 L 1 mol·L-1的CH3COOH溶液中,CH3COO-数目为NA
D.常温常压下,16 g臭氧所含的氧原子数目为NA
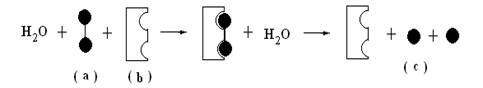 5、已知有一过程如下:
5、已知有一过程如下:
根据上图,a、b、c可分别表示( )
A、淀粉、酶、葡萄糖 B、蔗糖、酶、果糖
C、纤维素、酶、葡萄糖 D、麦芽糖、酶、葡萄糖
6.下列各组物质混合后,既产生无色气体,又产生白色沉淀的是:
①Ba(NO3)2稀溶液跟NaHSO3溶液,②Ba(OH)2溶液跟(NH4)2SO4溶液共热,
③电石跟苏打水,④三氯化铁溶液跟碳酸氢钠溶液。( )
A.①②③④ B.②③ C.①②③ D.②③④
7.有人欲配制含下列不同阴、阳离子的溶液,其中能配制成功的是 ( )
A.Na+、NH4+、Cl—、NO3— B.Ba2+、NH4+、CO32—、HCO3—
C.H+、K+、I—、ClO— D.Cu2+、Na+、S2—、SO42—
8.在铜的催化作用下氨气与氟气反应,得到一种三角锥形分子M和一种铵盐N。下列有关说法不正确的是 ( )
A.该反应的化学方程式为4NH3+3F2=NF3+3NH4F
B.M是极性分子,其还原性比NH3强
C.M既是氧化产物,又是还原产物
D.N中既含有离子键,又含有共价键
9.下列反应离子方程式正确的是( )
A.溴化亚铁溶液中通入过量氯气:
Fe2+ + 2Br— + 2Cl2= Fe3+ + Br2 + 4Cl—
B.氯气通入冷的氢氧化钠溶液中: 2Cl2 + 2OH— = 3Cl—+ ClO—+ H2O
C.向澄清石灰水中加入少量小苏打溶液: Ca2+ + OH—+ HCO3— =CaCO3↓+ H2O
D.氨水中通入过量二氧化硫: 2NH3·H2O + SO2 = 2NH4+ + SO32—+ 2H2O
10.常温下将稀NaOH溶液与稀醋酸溶液混合,不可能出现的结果是 ( )
A、pH>7, 且c(Na+)>c(OH—)> c(CH3COO—)> c(H+)
B、pH>7, 且c(Na+)+ c(H+)=c(OH—)+ c(CH3COO—)
C、pH<7, 且c(CH3COO—) > c(H+)> c(Na+)> c(OH—)
D、pH=7, 且c(CH3COO—)>c(Na+)>c(OH—)= c(H+)
11.在一定条件下化学反应:2SO2(g)+O2(g)![]() 2SO3(g);△H=-197 kJ/mol 现有容积相同的甲、乙、丙三个恒容容器,在上述条件下分别充入的气体和反应放出的热量(Q)如下表所列:
2SO3(g);△H=-197 kJ/mol 现有容积相同的甲、乙、丙三个恒容容器,在上述条件下分别充入的气体和反应放出的热量(Q)如下表所列:
| 容器 | SO2(mol) | O2(mol) | N2(mol) | Q(kJ) |
| 甲 | 2 | 1 | 0 | Q1 |
| 乙 | 1 | 0.5 | 0 | Q2 |
| 丙 | 1 | 0.5 | 1 | Q3 |
根据以上数据,下列叙述不正确的是( )
A.在上述条件下反应生成1 molSO3气体放热98.5 kJ
B.丙容器中N2对反应热无影响。
C.Q1=2Q2=2Q3=197
D.2Q2=2Q3<Q1<197 kJ
12、下列反应达到平衡后,增大压强或升高温度,平衡都向正反应方向移动的是 ( )
A.2NO2(g) ![]() N2O4(g)(正反应为放热反应)
N2O4(g)(正反应为放热反应)
B.3O2(g) ![]() 2O3(g)(正反应为吸热反应)
2O3(g)(正反应为吸热反应)
C.H2(g)+I2(g)
![]() 2HI(g)(正反应为放热反应)
2HI(g)(正反应为放热反应)
D.NH4HCO3(s) ![]() NH3(g)+H2O(g)+CO2(g)(正反应为吸热反应)
NH3(g)+H2O(g)+CO2(g)(正反应为吸热反应)
13、某炔烃氢化后得到的饱和烃如下:CH3-![]() CH2-CH2-
CH2-CH2-![]() CH3,该炔烃可能的结构有( )
CH3,该炔烃可能的结构有( )
A. 1种 B. 2种 C. 3种 D. 4种
14、某有机物中可能有甲酸、乙酸、甲醇和甲酸乙酯四种物质中的一种或几种,在鉴定时有下列现象:①发生银镜反应 ②加入新制的氢氧化铜悬浊液,沉淀不溶解 ③与含酚酞的NaOH溶液共热时,发现红色变浅。则下列结论中正确的是( )
A.四种物质都有 B.有甲酸乙酯和甲酸
C.有甲酸乙酯和甲醇 D.有甲酸乙酯,可能有甲醇
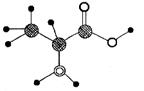 15、下图是某有机物分子的简易球棍模型,该有机物中只含C、H、O、N四种元素。下列关于该有机物的说法中错误的是( )
15、下图是某有机物分子的简易球棍模型,该有机物中只含C、H、O、N四种元素。下列关于该有机物的说法中错误的是( )
A.分子式为 C3H7O2N
B.能发生取代反应
C.能通过聚合反应生成高分子化合物
D.不能跟NaOH溶液反应
16.已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性强弱的顺序是SO2>I->H2O2>Fe2+>Cl-,则下列反应不可能发生的是
A.2Fe3++SO2+2H2O====2Fe2++SO![]() +4H+
+4H+
B.2Fe2++Cl2====2Fe3++2Cl-
C.I2+SO2+2H2O====H2SO4+2HI
D.H2O2+H2SO4====SO2+O2+2H2O
17、1mol某有机物在稀硫酸作用下,水解生成2mol相同的物质。下列物质中:
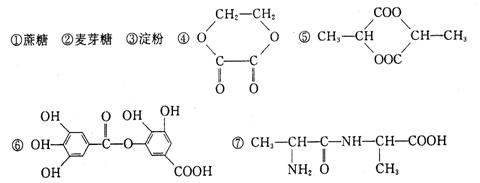

符合题意的物质可能是( )
A.①②⑤⑦ B.④⑤⑦ C.②⑤⑥⑦ D.①④⑤⑥
18.将适量的铁粉放入氯化铁溶液中,完全反应后,溶液中亚铁离子和铁离子的物质的量浓度相等,则已反应的铁离子和未反应的铁离子物质的量浓度之比是
A. 3∶2. B. 2∶3 C.1∶2 D. 1∶1
高二化学试题
一、选择题(每题只有一个选项符合题意,每小题3分,共54分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | |||||||||
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
第Ⅱ卷(非选择题,46分)
19.(4分)下列有关化学实验的基本操作及安全知识的叙述,不正确的是 。(填序号)
A.用托盘天平称取10.50g干燥的NaCl固体
B.附着于试管内壁的苯酚,可用碱液洗涤
C.用碱式滴定管量取20.00mL0.1000mol/L的高锰酸钾溶液
D.用渗析法分离淀粉中混有的NaNO3杂质
E.配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌
F.切割白磷时,必须用镊子夹取,置于桌面上的玻璃片上,小心用刀切割
G.实验时,不慎打翻燃着的酒精灯,可立即用湿抹布盖灭火焰
H.用重结晶法可以除去硝酸钾中混有的少量氯化钠
I.配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用滴管吸去多余的部分。
20、(12分)室温下,单质A,B,C分别为固体、黄绿色气体、无色气体,在合适反应条件下,它们可以按下图进行反应。又知E溶液是无色的,请回答:
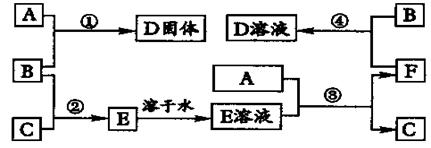
(1)A是 、C是 (请填名称);B的电子式__________。
(2)反应①的化学方程式为: 。
(3)反应③的化学方程式为: 。
(4)反应④的离子方程式为: 。
21.(18分)现有烯烃A可合成饱和酯G:
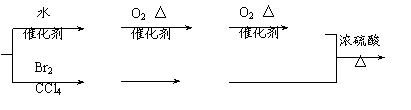
B C D
|
E F
(1)、A、G的结构简式分别是:A__________________G、____________________。
(2)、写出下列反应方程式,并注明反应类型
![]() ①、E
F:
①、E
F:
___________________________________________ ______________
![]() ②、D
+ F
G :
②、D
+ F
G :
___________________________________________ ______________
(3)、写出与D的通式相同,碳原子个数是D的两倍,属于酯类的所有同分异构体的结构简式
_____________、______________、____________、_______________。
22.(12分)某校化学小组学生进行如下实验。
(1)使用铜和稀硫酸制备硫酸铜晶体。
步骤如下
|
|
|
| ||||||||
| ||||||||
步骤①观察到的现象是 。
步骤③的主要操作包括: 。
(2)硫酸铜溶解度的测定。
 用石墨电极(相同)电解饱和CuSO4溶液,阴极的电极反应式
用石墨电极(相同)电解饱和CuSO4溶液,阴极的电极反应式
是 。已知饱和CuSO4溶液的质量为60 g,通电10 min后,溶液恰好变为无色。称量发现两电极质量差为4 g,此温度下CuSO4的溶解度是 ___ 。
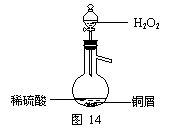
(3)某同学查询资料得知:铜屑放入稀硫酸中不发生反应,若在稀硫酸中加入H2O2,铜屑可逐渐溶解。实验小组同学设计实验装置如右图,验证该实验,该反应的化学方程式
是 。
若将H2O2和稀硫酸加入烧瓶中的顺序颠倒,实验得
到的结论是
。
草 稿 纸
高二化学试题参考答案
一、选择题(每题只有一个选项符合题意,每小题3分,共54分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | A | D | B | D | D | C | A | B | C |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | D | C | B | A | D | A | D | C | B |
第Ⅱ卷(非选择题,46分)
19. ACFI (4分)
20、(12分)
(1)铁、氢气 Cl2 的电子式(各1分)
(2)2Fe+3Cl2![]() 2FeCl3
2FeCl3
(3)2HCl+Fe =FeCl2+H2↑
(4)2Fe2+ + Cl2 = 2Fe3+ + 2CI- (各3 分)
21.(18分) (反应类型各1分,其余各2分)
(1)、A__________________G、____________________。
(2)、写出下列反应方程式,并注明反应类型
![]() ①、E
F:
①、E
F:
___________________________________________ ______________
![]() ②、D
+ F
G :
②、D
+ F
G :
___________________________________________ ______________
(3)、
_____________、______________、____________、_______________。
22. (12分)(1)红色固体变黑; 加热浓缩,冷却结晶,过滤………(各2分,共4分)
(2)Cu2++2e-==Cu 20 g………(各2分,共4分)
(3)Cu+H2O2+H2SO4=CuSO4+2H2O 铜屑放入H2O2中不发生反应,若在H2O2中加入稀硫酸,铜屑可逐渐溶解。………(各2分,共4分)