化学选修三专题4分子空间结构与物质性质测试题
第 Ⅰ 卷(选择题 共48分)
一、选择题(每小题只有一个选项符合题意,每小题3分,共48分。)
1、下列各组物质中,都是由极性键构成为极性分子的一组的 ( )
A、CH4 和 H2O B、CO2 和 HCl
C、NH3 和 H2S D、HCN 和 BF3
2、下列分子中,键的极性最强的是 ( )
A.PH3 B.H2S C.HBr D.HCl
3、下列哪种物质本身所具有的能量最低 ( )
A、HI B、HBr C、 HCl D、HF
4、下列分子或离子中,含有孤电子对的是 ( )
A、H2O B、CH4 C、SiH4 D、NH4+
5、既有离子键又有共价键和配位键的化合物是 ( )
A、NH4NO3 B、NaOH C、H2SO4 D、H2O
6.下列粒子属等电子体的是 ( )
A、NO和O2 B、CH4和NH4+ C、NH2—和H2O2 D、HCl和H2O
7、现已知O3分子为V字形结构,O3在水中的溶解度和O2比较要大或小 ( )
A、O3在水中的溶解度和O2一样 B、O3在水中的溶解度比O2小
C、O3在水中的溶解度比O2要大 D、没办法比较
8、最近,中国科大的科学家们将C60分子组装在一单层分子膜表面,在—268℃时冻结分子的热振荡,并利用扫描隧道显微镜首次“拍摄”到能清楚分辨碳原子间单、双键的分子图像。下列化合物分子中一定既含单键又含双键的是
( )
A、CO2 B、COCl2 C、C2H4O D、H2O2
9、膦(PH3)又称磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中常含有磷化氢。以下关于PH3的叙述不正确的是 ( )
A、PH3分子中有未成键的孤电子对 B、PH3是极性分子
C、它的分子构型是三角锥形 D、磷原子采用sp2杂化方式
10、关于氢键,下列说法正确的是 ( )
A、每一个水分子内含有两个氢键
B、冰、水和水蒸气中都存在氢键
C、分子间形成的氢键使物质的熔点和沸点升高
D、H2O是一种非常稳定的化合物,这是由于氢键所致
11、下列各组酸中,酸性依次增强的是 ( )
A、H2CO3 、H2SiO3 、 H3PO4 B、HNO3 、 H3PO4 、H2SO4
C、 HI、 HCl、 H2S D 、HClO 、 HClO3 、 HClO4
12、同一主族的两种元素的原子序数之差不可能是 ( )
A.16 B.26 C.36 D.46
13、几种短周期元素的原子半径及主要化合价见下表:
| 元素符号 | A | B | C | D | E |
| 原子半径(nm) | 0.160 | 0.080 | X | 0.143 | 0.074 |
| 主要化合价 | +2 | +2 | -2,+4,+6 | +3 | -2 |
则X可能的数值为 ( )
A.0.069 B.0.102 C.0.145 D.0.184
14、下列电子排布式中,属于第121号元素的是 ( )
A.[118]5g18s2 B.[118]8s28p1 C.[118]7d18s2 D.[118]6f18s2
15、右图中曲线表示原子序数在前20号中的某些元素的原子序数(按递增顺序连续排列)和单质沸点的关系,其中A点表示的元素是 ( )
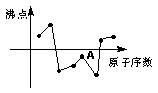 |
A、Si B、Al C、F D、S
16、SF6是一种无色气体,具有很强的稳定性,可用于灭火。SF6的分子结构如下图所示,呈正八面体型。如果F元素有两种稳定的同位素,则SF6的不同分子种数为 ( )
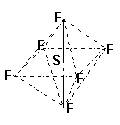 A、6种 B、7种 C、10种 D、12种
A、6种 B、7种 C、10种 D、12种
第 Ⅱ 卷(非选择题 共52分)
二、(每空2分,共52分)
17、用价层电子对理论(VSEPR)判断:
| 物质 | 孤电子对数 | 轨道杂化形式 | 分子或离子的形状 |
| SO3 | |||
| PO43- | |||
| NCl3 |
18、
|
| |||||||||||||||||||||
|
|
| ||||||||||||||||||||
|
| |||||||||||||||||||||
(1)在上面元素周期表中全部是金属元素的区域为 。
(a) A (b) B (c) C (d) D
(2)有人认为形成化合物最多的元素不是IVA族的碳元素,而是另一种短周期元素,请你根据学过的化学知识判断这一元素是 。
(3)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
①画出甲原子的基态电子排布:
甲 。
② 甲、乙两元素相比较,金属性较强的是 (填名称),可以验证该结论的实验是 。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
19、碘在不同溶剂中呈现紫色、棕色,一般认为溶液呈紫色时表明溶解了的“碘分子”并未和溶剂发生很强的结合。已知不同温度下,碘在石蜡油中的溶液呈紫色或棕色。请回答:温度低时溶液呈 色,温度高时溶液呈 色,因为
。
20、氮可以形成多种离子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于 NH4+的性质。
(1)写出N2H62+与碱溶液反应的离子方程式 。
(2)NH2-的电子式为 。
(3)N3-有 个电子。
(4)写出N3-等电子体物质的化学式 。(一种)
(5)等电子数的微粒往往具有相似的结构,试预测N3—的构型 。
(6)据报道,美国科学家卡尔·克里斯特于1998年11月合成了一种名为“N5”的物质,由于其具有极强的爆炸性,又称为“盐粒炸弹”。迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N≡N键。则“N5”分子碎片所带电荷是
。
21、二聚甲酸解聚反应为:(HCOOH)2![]() 2HCOOH,该反应需吸收
2HCOOH,该反应需吸收![]() 的能量,此能量是
断开
所需的能量,所以此键的键能为
的能量,此能量是
断开
所需的能量,所以此键的键能为 ![]() 。写出(HCOOH)2的结构式
。
。写出(HCOOH)2的结构式
。
化学选修3 分子空间结构与物质性质测试题
一、 择题(每小题3分,共48分,每小题只有一个选项符合题意)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | C | D | D | A | A | B | C | B | D | C | D | D | B | A | C | C |
二、(每空2分,共52分)
17、用VSEPR 理论判断:
| 物质 | 孤对电子对数 | 轨道杂化形式 | 分子或离子的形状 |
| SO3 | 0 | Sp2 | 平面三角形 |
| PO43- | 0 | Sp3 | 正四面体 |
| NCl3 | 1 | Sp3 | 三角锥形 |
18、(1)b (2)H (3)①1S22S22P63S23P1 ② 镁 b、c
19、棕色、紫色,因为温度升高,分子间作用力减弱。
20、(1)N2H62++2OH-=N2H4+2H2O
(2)![]()
(3)22
(4)N2O CO2 CNO- BeF2 CaH2 等
(5)直线型(1分)
(6)一个单位正电荷
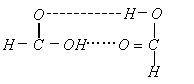 |
21、2个氢键,所以键能为![]()