高二化学(综 合 题)检测题
命题人:af 学号________. 姓名________.
第Ⅰ卷(选择题)
一.选择题 (请将你认为正确的答案代号填在Ⅱ卷的答题栏中,本题共18小题)
1. 下列叙述中不正确的是
A.能跟酸反应的氧化物,不一定是碱性氧化物
B.凡具有正四面体结构的分子中,其键角均为109 度28分
C.有新单质生成的化学反应不一定都是氧化-还原反应
D.在100 ℃和1.01×10![]() 帕时,18克水蒸气含有6.02×10
帕时,18克水蒸气含有6.02×10![]() 个水分子
个水分子
2. 设N![]() 为阿伏加德罗常数,下列叙述正确的是
为阿伏加德罗常数,下列叙述正确的是
① 4克Ca变为Ca![]() 失去的电子数目为0.1N
失去的电子数目为0.1N![]()
② 在标准状况下,40克SO2所占的体积约为11.2升
③ 18克重水所含的电子数是9N![]()
④ 1.6克NH![]() 离子中含有的电子数为 0.8N
离子中含有的电子数为 0.8N![]()
A.①、② B.②、④ C.②、③ D.③、④
3. 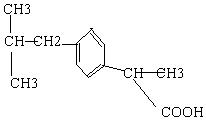 具有解热镇痛及抗生素作用的药物“芬必得”,
具有解热镇痛及抗生素作用的药物“芬必得”,
其主要成分的结构式如图 它属于
A.芳香族化合物
B.苯甲酸的同系物
C.易溶于水的有机物
D.易升华的物质
4. 在制玻璃、制皂、造纸、纺织等工业生产中都需要的物质是
A.氧化钙 B.纯碱 C.石灰石 D.氯化钠
5. 向25毫升18.4 摩/升硫酸溶液中加入足量的铜片并加热,等充分反应后,被还原的硫
酸的物质的量为
A.等于0.46 摩 B.大于0.23 摩,小于0.46 摩
C.等于0.23 摩 D.小于0.23 摩
6. 在Zn 跟稀硝酸反应时,若参加反应的Zn 与消耗的HNO3 的物质的量之比为1 :2.5时,则被还原的HNO3和未被还原的HNO3的物质的量之比为
① 2 :5 ② 1 :4 ③ 1 :5 ④ 1 :9
A.①、② B.②、④ C.②、③ D.③、④
7. 合成氨所需的氢气可由水煤气反应制得,其中的一步反应为:
![]() CO(g)+H2O(g) CO2(g)+H2(g);△H=-43kJ·mol-1对于上述反应,下列措施中能提高CO转化率的是
CO(g)+H2O(g) CO2(g)+H2(g);△H=-43kJ·mol-1对于上述反应,下列措施中能提高CO转化率的是
A.增大压强 B.升高温度
C.增大水蒸气的浓度 D.增大CO的浓度
8. 下列说法中不正确的是
A.任何酸都不能与二氧化硅发生氧化-还原反应
B.二氧化硅是制造水泥的主要原料,它在高温下可与石灰石发生反应
C.二氧化硅属于原子晶体,具有四面体的空间网状结构
D.烟水晶的主要成分为二氧化硅
9. 下列关于阿伏加德罗常数(NA)的说法中,正确的是
A.如果5.6LN2中,含有n个氮分子,则NA一定为4n
B.在常压、室温条件下,1mol氦气含有的原子数为NA
C.在100mL 0.5mol·L-1乙酸溶液中含乙酸分子数为0.05 NA
D.15.6g Na2O2与过量CO2充分反应时,转移的电子数为0.2 NA
10. 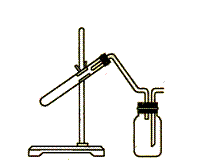 右图是制取和收集某气体的实验装置,下列各项制备气体方案,可用该装置实施的是
右图是制取和收集某气体的实验装置,下列各项制备气体方案,可用该装置实施的是
A.用Zn与稀盐酸反应制H2
B.用Na2O2与H2O反应制O2
C.用Cu与稀硝酸反应制NO
D.用MnO2与浓盐酸反应制Cl2
11. 用石墨电极电解含有少量NaOH的500mL NaCl溶液,当阴极产生5.6L(标况下)气体时停止电解,此时溶液中还有剩余的NaCl。若电解前溶液的pH=8,则电解后溶液的pH接近于下列的(假设电解前后溶液体积不变)
A.11 B.12 C.13 D.14
12. 下列各组物质中,前者为附着在试管内壁的残余物,后者为某同学所选用的洗涤剂.后者不能溶解前者的是
A.红磷 -- 二硫化碳 B.二氧化锰 -- 浓盐酸
C.苯酚 -- 氢氧化钠 D.油脂 -- 酒精
13. 某无色混合气体可能由CH4、NH3、H2、CO、CO2和HCl中的某几种气体组成。在恒温压条件下,将此混合气体通过浓硫酸时,气体总体积基本不变;再通过过量的澄清石灰水,未见变浑浊现象,但混合气体的总体积减小,把剩余气体导出后,在O2中能够被点燃,燃烧产物不能使CuSO4粉末变色。则原混合气体的成份是下列的
A.HCl和CO B.HCl、H2和CO
C.CH4和NH3 D.HCl、CO和CO2
14. 在硫铁矿(FeS2)与O2之间发生如下反应:4 FeS2+11 O2![]() 8SO2+2Fe2O3,则氧化产物为
8SO2+2Fe2O3,则氧化产物为
A.SO2 B.Fe2O3 C.SO2,FeS2 D. SO2,Fe2O3
15. 下列物质的溶液吸收SO2后,既无沉淀生成也无气体产生的是①BaCl2 ②NaHCO3
③Na2SO3 ④Na2SiO3 ⑤溴水
A.只有①②③ B.只有②③⑤ C.只有①③⑤ D.只有④⑤
16. 在下列各组物质中,只具有还原性的是
A.Na,I-,S2- B.F-,CO,Na+
C.Fe3+,SO42-,NO3- D. Fe2+,O2,H2S
17. 镁、铁混合物4.9g,溶解在过量某浓度的稀硝酸中,完全反应得到标准状况下的气体2.24L假设气体全为NO),则向反应后的溶液中加入足量的烧碱,下列的数据中与可生成的沉淀的量最接近的是
A.6g B.10g C.8g D.12g
18. 现有40℃时KNO3的饱和溶液82.0g,当温度下降至10℃时,溶液质量为60.5g,此时需加水102.4g才能使析出的晶体恰好全部溶解,则40℃时,KNO3的溶解度是
A.32g B.64g C.40.5g D.21.5g
第Ⅱ卷(非选择题 共3道简答题2道实验题2道计算题
请将你认为正确的答案代号填在下表中
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 16 | 17 | 18 | ||||||||||||
二.简答题 (共3小题)
19. 在一定条件下,在一个容积固定的反应器中,有一可左右滑动的密封隔板,两侧进行如图所示的反应(均加有适量的新型固体催化剂,其体积可忽略不计)
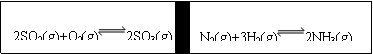
⑴若起始时两边分别投入2 mol SO2、1 mol O2;1 mol N2、3 mol H2,达到平衡后,隔板能否处于中央 (填“是”或“否”)。
⑵若起始时投入2 mol SO2、1 mol O2;1 mol N2、2 mol H2,达到平衡后,隔板仍处于中央,则SO2的转化率和N2的转化率之比为 (填数字);
⑶若起始时投入2 mol SO2、1 mol O2;1 mol N2、a mol H2、0.1 mol NH3,起始时右侧体积小于左侧体积,当a值在一定范围内变化时,均可通过调节反应器温度,使左右两侧反应都达到平衡,且平衡时隔板处于中央,此时SO2的转化率与N2的转化率之比为5:1,求a的取值范围
20. 从香料八角中提取的莽草酸是合成治疗禽流感的药物——达菲(Tamiflu)的原料之一,达菲是抗禽流感病毒特效药物。
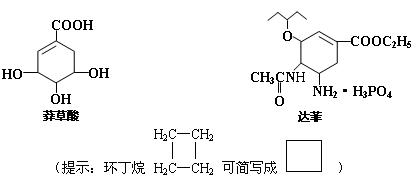
(1)莽草酸中含有的官能团有 ;(写名称)
(2)根据达菲分子的结构推测它可能发生的反应类型有: ;
(3)请写出莽草酸与乙醇反应的化学方程式(有机物用结构简式表示):
____________________________________________;
21. 下图为某些常见物质之间的转化关系。已知:A、B、I中含有相同的阳离子且都是XY2型化合物,I是常用的干燥剂,单质F常用作自来水消毒。
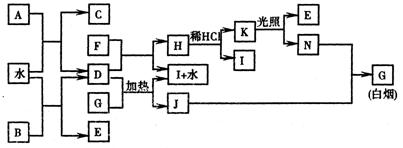
请按要求填空:
(1) A的电子式是 、B的电子式是 、
K的结构式是 、C的结构式是 ;
(2) D与G反应的化学方程式是 ;
(3 含1mol N的稀溶液与足量稀氢氧化钠溶液完全中和,放出57.3kJ的热量,则表示该反应中和热的热化学方程式为: 。
三.实验题 (共2小题)
22. 常温下,取两片质量相等、外形和组成相同表面经过砂纸打磨(完全除掉了氧化物)的铝片,分别加入到盛有体积相同、c(H+)相同的稀硫酸和稀盐酸溶液的两支试管(相同体积)中,铝片在稀盐酸中产生的氢气的速率比在稀硫酸中快。
(1)写出以上反应的离子方程式_____________________________________________;
(2)你认为出现以上现象的可能原因是:
假设①___________________________________________________________;
假设②___________________________________________________________________。
(3)请设计实验对以上的假设进行验证:
①_____________________________________________________________________
___________________________________________________________________________;
②__________________________________________________________________________
_____________________________________________________________________________。
(4)如果上述假设都成立,要使以上稀硫酸与铝反应产生的氢气速率加快,可以采取的措施有:
①______________________________________________________________________;
②______________________________________________________________________;
③______________________________________________________________________;
④______________________________________________________________________。
23. 实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验。
(1)根据什么现象可判断铜跟浓硫酸反应有SO2生成______________________。
根据什么现象可判断铜跟浓硫酸反应有硫酸铜生成________________________。
写出甲装置中发生的主要反应的化学方程式_____________________________。
(2)你在实验室中进行这个实验时,除了1.小题中指到的实验现象外,还可以观察到许多其它的实验现象,请写出两种:____________________________________、___________________________________。
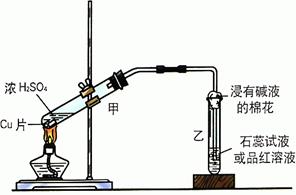 (3)装置乙的试管口部放有一团浸有碱液的棉花,棉花中通常是浸有饱和碳酸钠溶液,写出棉花中发生反应的化学方程式___________________________________。
(3)装置乙的试管口部放有一团浸有碱液的棉花,棉花中通常是浸有饱和碳酸钠溶液,写出棉花中发生反应的化学方程式___________________________________。
四.计算题 (共2小题)
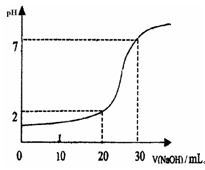
24. 右图为10mL一定物质的量的盐酸用一定浓度的NaOH溶液中和的图示,依据图示推算出HCl和NaOH的物质的量浓度各是多少?(注:溶液混合时造成的体积缩小忽略不计)
25. 我国推广食用加碘盐。根据GB5461——《国家食用盐标准》,碘元素含量为20~50mg/kg为合格。质量监督部门为检测某品牌加碘盐是否合格,进行了如下实验:称取250g 某品牌加碘盐样品,在酸性条件下用足量KI溶液将其中IO3-全部转化成I2,生成的I2再用0.010mol/L的硫代硫酸钠溶液滴定,滴定到终点时用去24 mL。
有关反应如下:(未配平)
①IO3-+I-+H+—I2+H2O
②I2+S2O32-—I-+S4O62-
⑴写出配平了的上述两个反应方程式 、 ;
⑵用硫代硫酸钠溶液滴定I2时,应用_________作指示剂,滴定到终点的现象是________;
⑶试通过计算说明该加碘食盐是否为合格产品(写出具体的计算过程)。
高二化学(综 合 题)检测题
参考答案(仅供参考)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| B | D | A | B | D | B | C | B | D | A | D | A | A | D | C |
| 16 | 17 | 18 | ||||||||||||
| A | B | B |
二.简答题答案:
19. ⑴能 (1分) ; ⑵2:1 (2分) ; ⑶1.3<A<1.9 (2分)
20. (1)羟基、羧基、碳碳双键(3分) (2)加成、水解(或取代)、氧化(3分)
(3)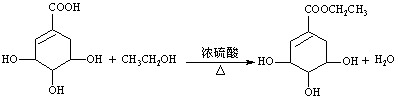 (2分)
(2分)
21. ![]()
![]()
![]()
![]() ⑴A
B
K
C
⑴A
B
K
C
(每空1分共4分)
⑵
Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O (2分)
CaCl2+2NH3↑+2H2O (2分)
⑶ HCl(aq) +NaOH(aq)=NaCl(aq)+H2O(L);△H=-57.3kJ/mol (3分)
三.实验题答案:
22. (1)2Al+6H+==2Al3++3H2↑(1分)
(2)①Cl-对铝与H+反应有促进作用;②SO42-对铝与H+反应有抑制作用。(每空1分,共2分)
(3)①向以上稀硫酸中加入少量的氯化钠或氯化钾(或其他可溶性氯化物)固体,如果都能使反应速率加快,则假设①成立;②向以上稀盐酸中加入少量的硫酸钠或硫酸铵(或其他可溶性硫酸盐)固体,如果都能使反应速率减慢,则假设②成立。(每空2分,共4分)
(4)①加入含有Cl-的可溶性氯化物;②增加H+浓度;③加热;④将铝片改换成铝丝⑤利用不活泼金属或不活泼金属可溶性盐形成原电池等。(只要求回答4点。每个1分,共4分)。
(本题若有其他合理解答参照给分。)
23. (1)乙中品红褪成无色;甲中溶液显蓝色。Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O。
(2)装置甲试管内溶液变黑色浑浊;装置甲中试管上部有白雾;反应开始时铜片表面变黑并有气泡产生……
(3)Na2CO3+SO2=Na2SO3+CO2↑
四.计算题答案:
24. c (HCl) = 0.09mol/L, c (NaOH) = 0.03mol/L
25. (1)①IO3-+5I-+6H+=3I2+3H2O ②I2+2S2O32-=2I-+S4O62-
⑵淀粉溶液 (1分); 蓝色刚好褪去 (1分)
⑶(4分)由①②方程式可知:IO3---3I2--6 S2O32-
n(IO3-)=![]() n(S2O32-)=
n(S2O32-)= ![]() ×0.024 L×0.010mol/L=4×10-5mol
×0.024 L×0.010mol/L=4×10-5mol
则250g 样品中含有碘元素的质量为:4×10-5mol×127g/mol×1000mg/g=5.08mg
该加碘食盐中碘元素的含量为:5.08mg/0.250kg=20.32mg/kg
因为20.32mg/kg<20mg/kg,所以该碘盐合格