高二化学第一学期期中考试试题
总分100分
第Ⅰ卷(选择题,共50分)
一、单选题(每小题只有1个正确答案,每小题2分,共50分)
1、下列说法正确的是( )
A、通常情况下,氮气的性质不活泼是因为氮元素的非金属性很弱的缘故
B、氮气是非极性分子,氨气是极性分子
C、白磷和红磷互为同素异形体,它们之间的相互转化为物理变化
D、五氧化二磷是磷酸的酸酐,二氧化氮是硝酸的酸酐
2、以下事实不能用勒夏特列原理解释的是( )
A、增大压强,有利于二氧化硫和氧气反应生成三氧化硫
B、工业制取硫酸和合成氨反应都要使用催化剂
C、合成氨工业生产中,把合成塔中的氨气不断抽出
D、实验室常用排饱和食盐水的方法收集氯气
3、下列有关方程式书写正确的是( )
A、H2CO3的电离:H2CO3![]() 2H+
+CO32-
2H+
+CO32-
B、NaHCO3的水解:HCO3-+H2O ![]() H3O++CO32-
H3O++CO32-
C、Cu与稀HNO3反应:Cu+4H++2NO3- = Cu2++2NO↑+2H2O
D、NH4Cl的水解:NH4++H2O
![]() NH3·H2O+H+
NH3·H2O+H+
4、下列各组气体通常状态下能稳定共存,并均能用浓硫酸干燥的是( )
A、NH3,O2,HCl B、NO,NO2,O2 C、N2,H2,HCl D、H2,N2,NH3
5、磷和氮处于同一主族,它们对应的化合物在结构上、性质上有许多相似之处。下列对化合物PH4I的描述正确的是( )
A、它是一种共价化合物 B、加热时不分解
C、不与AgNO3溶液反应 D、和消石灰共热可得PH3气体
6、可逆反应2SO2(g)+O2(g)
![]() 2SO3(g),在体积为2L的密闭容器中进行,如果SO2在某时刻的物质的量为4mol,2min后变为3.6mol,则用O2的浓度变化表示这段时间的反应速率为( )mol·(L·min) -1
2SO3(g),在体积为2L的密闭容器中进行,如果SO2在某时刻的物质的量为4mol,2min后变为3.6mol,则用O2的浓度变化表示这段时间的反应速率为( )mol·(L·min) -1
A、0.05 B、0.2 C、0.1 D、0.4
7、250C时,浓度均为1mol/L 的 (NH4)2SO4,(NH4)2CO3,(NH4)2Fe(SO4)2溶液中,测得C(NH4+)分别为a,b,c(单位为mol.L-1),下列判断正确的是( )
A、a=b=c B、a>b>c C、c>a>b D、a>c>b
8、下列事实中一定不能证明 CH3COOH是弱电解质的是( )
①常温下,某CH3COONa溶液的PH=8。② 用CH3COOH溶液做导电性实验,灯泡很暗。③ 等PH等体积的盐酸、醋酸溶液分别和足量锌反应,醋酸放出的氢气较多。④ 0.1mol/L的CH3COOH溶液PH=2.1。⑤ CH3COONa和H3PO4反应,生成CH3COOH。⑥ 氢离子浓度为0.1mol/L的CH3COOH溶液稀释100倍,PH<3
A、② B、②⑤ C、①③⑤⑥ D、①③④⑤⑥
9、足量的铁粉与一定量的盐酸反应,由于反应速率太快,为了减慢此反应速率而不减少H2的产量,可以加入的物质是( )
![]() A、盐酸
B、CH3COONa
C、Na2CO3
D、NaOH
A、盐酸
B、CH3COONa
C、Na2CO3
D、NaOH
10、反应3Fe(S)+4H2O(g) Fe3O4(S)+4H2(g)在密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
A、把块状铁变为铁粉
B、将容器的体积扩大为原来的2倍
C、保持压强不变,充入N2使容器的容积增大
D、保持容器容积不变,充入N2使体系压强增大
11、下列反应:2HBr(g) ![]() Br2(g)+H2(g)在密闭容器中进行,将密闭容器的体积缩小至原来的一半
,下列说法正确的是()
Br2(g)+H2(g)在密闭容器中进行,将密闭容器的体积缩小至原来的一半
,下列说法正确的是()
A、化学反应速率不变,平衡不移动
B、化学反应速率加快,平衡不移动
C、平衡向右移动,气体颜色加深
D、平衡不移动,气体颜色不变
12、下列说法正确的是( )
A、PH=3的盐酸和PH=5的盐酸等体积混合后,溶液PH=4
B、当温度不变时,向纯水中加入强酸溶液,水的离子积常数增大
C、常温下,将甲酸和NaOH溶液混合后溶液PH=7,则溶液中c(HCOO-)=c(Na+)
D、酸碱中和滴定达到滴定终点时,溶液一定呈中性
13、常温下,某无色溶液中由水电离产生的c(H+)与c(OH-)满足关系式c(H+)·c(OH-)=1×10-24, 则下列离子在该溶液中一定能大量共存的是( )
A、Ba2+,Na+, NO3-,Cl- B、Na+, Cl-, SO42-, HCO3-
C、K+,Na+,MnO4-,SO42- D、NH4+,Na+,NO3-,SO42-
14、将2molA气体和1molB气体在1L密闭容器中混合,在一定条件下发生反应:2A(g)+B(g) ![]() 2C(g),2min后达到平衡状态,测得C的浓度为0.6
mol·L-1,下列说法正确的是( )
2C(g),2min后达到平衡状态,测得C的浓度为0.6
mol·L-1,下列说法正确的是( )
A、达到平衡状态时,v (A)正= v(B)逆
B、使用适宜的催化剂,因活化分子百分数增大可使反应速率加快
C、减小压强,正反应速率减小,逆反应速率增大,平衡向逆反应方向移动
D、保持温度和压强不变,向该平衡体系中再充入1molC(g),再次平衡时,A的平衡浓度变为2.4 mol·L-1
15、一定条件下,达到平衡状态时的可逆反应2A(g)
![]() 2B(g)+C(g)(正反应为吸热反应),要使B的物质的量增大,而正反应速率降低,可采取的措施是( )
2B(g)+C(g)(正反应为吸热反应),要使B的物质的量增大,而正反应速率降低,可采取的措施是( )
A、增加A的物质的量 B、减小A的物质的量
C、升高体系的温度 D、减小体系的压强
16、在密闭容器中,有可逆反应:nA(g)+mB(g)
![]() PC(g)(m+n>P, 正反应是吸热反应)处于平衡状态,下列说法正确的是( )
PC(g)(m+n>P, 正反应是吸热反应)处于平衡状态,下列说法正确的是( )
①升高温度时,C(B)/C(C)的值减小; ②降温时,体系内混合气体平均相对分子质量减小; ③加入B后,A的转化率增大; ④加催化剂,气体总物质的量不变; ⑤充入C后,A,B的物质的量增大
A、③④ B、②③⑤ C、①②⑤ D、全部
17、可逆反应3A(g) ![]() 3B(?)+C(?)(正反应为吸热反应),若升高温度,气体平均相对分子质量有减小趋势,则下列判断正确的是( )
3B(?)+C(?)(正反应为吸热反应),若升高温度,气体平均相对分子质量有减小趋势,则下列判断正确的是( )
A、B,C可能都是固体 B、B,C一定都是气体
C、若C是固体,则B一定是气体 D、无正确的答案
18、将22.4g铁粉逐渐加入到含HNO30.8mol的稀硝酸溶液中,反应生成气体的物质的量(y)随加入铁粉的物质的量(x)的变化关系中,正确的是( )
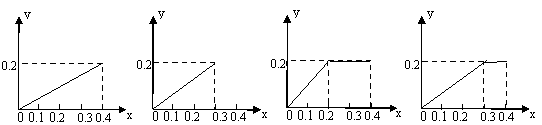
A B C D
19、将0.1mol·L-1的CH3COOH溶液加水稀释或加入CH3COONa晶体,都会引起( )
A、溶液中c(OH-)减小 B、溶液PH增大
C、CH3COOH的电离程度增大 D、溶液的导电能力减弱
20、向10ml 0.1 mol·L-1的NaOH溶液中加入相同体积相同浓度的CH3COOH溶液,反应后溶液中各微粒的浓度关系错误的是( )
A、c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B、c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C、c(Na+)=c(CH3COO-)+c(CH3COOH)
D、c(Na+)+ c(H+)=c(CH3COO-)+c(OH-)
21、常温下,向PH=2的硫酸溶液中加入等体积的下列溶液后,滴入甲基橙试液,出现红色,该溶液可能是( )
A、PH=12的Ba(OH)2溶液
B、PH=12的氨水
C、0.5 mol·L-1的BaCl2溶液
D、0.01 mol·L-1的NaOH溶液
22、有四种物质的量浓度相同的一价阳离子A+、B+和一价阴离子X-、Y-组成的盐溶液,根据测定,常温下AX溶液和BY溶液的PH都为7,AY溶液的PH值大于7,BX溶液的PH值小于7,据此推断,可能不水解的盐是( )
A、AX B、BX C、AY D、BY
23、在等温等容条件下,有反应2A(g)+2B(g)
![]() C(g)+3D(g),现分别从两条途径建立平衡: I.A、B的起始浓度均为2 mol·L-1
C(g)+3D(g),现分别从两条途径建立平衡: I.A、B的起始浓度均为2 mol·L-1
Ⅱ.C、D的起始浓度分别为2 mol·L-1和6 mol·L-1.
A、达到平衡时,I途径的反应速率和Ⅱ途径的反应速率相同( )
B、达平衡时,体系内混合气体的平均密度相同
C、I、Ⅱ两途径达到平衡时,体系内混合气体的百分组成相同
D、I、Ⅱ两途径达到平衡时,体系内混合气体的平均相对分子质量不同
24、将酸溶液甲和碱溶液乙等体积混合后,溶液PH<7,则下列叙述中不可能的情况是( )
①甲是弱酸,乙是强碱,混合后原酸碱溶液恰好中和。 ②甲是强酸,乙是弱碱,混合前甲中c(H+) 与乙中c(OH-)相等。 ③甲是强酸,乙是强碱,混合前c(甲)=c(乙)。 ④ 甲是弱酸,乙是强碱,混合前甲中c(H+)与乙中c(OH-)相等
A、①③ B、①② C、②③ D、②④
25、图中C%表示某气体反应物在体系中的百分含量,v表示反应速率,P表示压强,t表示反应时间,图(甲)为温度一定时,压强(P)与反应速率(v)的关系曲线,图(乙)为压强一定时,在不同时间体系中某气体反应物的百分含量(C%)与温度的关系曲线。同时符合以下两个图像的反应是( )
A、4NH3(g)+5O2(g)
![]() 4NO(g)+6H2O(g)(正反应是放热反应)
4NO(g)+6H2O(g)(正反应是放热反应)
B、N2O3(g)
![]() NO2(g)+NO(g)(正反应是吸热反应)
NO2(g)+NO(g)(正反应是吸热反应)
C、3NO2(g)+H2O(l)
![]() 2HNO3(l)+NO(g)(正反应是放热反应)
2HNO3(l)+NO(g)(正反应是放热反应)
D、CO2(g)+C(s)
![]() 2CO(g)(正反应是吸热反应)
2CO(g)(正反应是吸热反应)
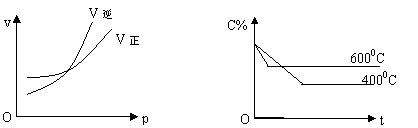 |
(甲) (乙)
第Ⅱ卷(非选择题,共50分)
二、填空题(每空2分,共40分)
26、(12分)(1)配制Al2(SO4)3溶液时,为防止水解,可加少量 ,若将此溶液加热蒸发再充分灼烧,所得产物为 ,硫酸铝溶液和碳酸氢钠溶液混合反应可作为泡沫灭火器的工作原理,有关反应的离子方程式为 。
(2)将0.4 mol·L-1的一元酸HA溶液与0.2 mol·L-1的NaOH溶液等体积混合后,溶液呈碱性。则:①混合溶液中共有 种微粒;
②混合溶液中,c(HA)+c(A-)= ;
③混合溶液呈碱性的合理解释为 。
27、(4分)配平下列化学方程式:
(1) 3 Cu2S+ 22 HNO3 = 6 Cu(NO3)2+ 10 NO↑+ 3 H2SO4+ 8 H2O
(2) 2 MnO4-+ 5 H2O2+ 6 H+ = 2 Mn2++ 8 H2O + 5 O2↑
28、(6分)将Vml NO和NO2的混合气体通过足量的水吸收后,得到aml无色气体A,将此无色气体A与等体积O2混合,再通过水充分吸收,收集到5ml无色气体B,则
(1)B气体是 ; (2)A气体体积是
(3)V的取值范围是
29、(10分)有a、b两个密闭容器,已知a容器的容积不变,b容器中的活塞可以上下移动,以保持内外压强相等。在相同条件下将3molA, 1molB分别同时混合于a、b两容器中,发生反应3A(g)+B(g)
![]() 2C(g)+D(g)。
2C(g)+D(g)。
(1)达平衡时,a中A、C的浓度分别M mol·L-1和N mol·L-1, b中A、C的浓度分别为m mol·L-1和n mol·L-1,则M m;(填“>”, “<”或无法比较)
(2)若将2molC和2molD充入a中,保持温度不变,平衡时C的浓度为Ymol·L-1,则Y和N之间的关系为Y N;(填“>”,“<”或无法比较)
(3)若将4molC和2molD充入a中,保持温度不变,平衡时A的浓度为W mol·L-1,则
A、W=2M B、W<M C、M<W<2M D、W>2M
(4)保持温度不变,按下列比例分别充入a,b两容器中,达到平衡后a中C的浓度仍为N mol·L-1的是 ,b中C的浓度仍为n mol·L-1的是 。
①6molA+2molB ②3molA+2molC
③2molC+1molB+1molD ④2molC+1molD
⑤1.5molA+0.5molB+1molC+0.5molD
30、(8分)某学生用0.1 mol·L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
A、移取20ml待测 盐酸溶液注入洁净的锥形瓶中,并加入2—3滴酚酞
B、用标准液润洗滴定管2—3次
C、把盛有标准溶液的碱式滴定管固定好,调节滴管尖嘴使之充满溶液
D、取标准液注入碱式滴定管至刻度0以上2—3厘米
E、调节液面至0或0以下刻度,记下读数
F、把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下读数
(1)正确操作步骤的顺序是(用字母序号填写) 。
(2)上述B步骤操作的目的是 。
(3)判断滴定终点的实验现象为 。
(4)若在上述A步骤操作之前,先用待测液润洗锥形瓶,则对滴定结果的影响是 (填“偏高”,“偏低”或“无影响”) 。
三、计算题(共10分)
31、(4分)某温度时,水的离子积常数为Kw=1×10—13,将此温度下PH=11的Ba(OH)2溶液aL与PH=1的H2SO4溶液bL混合,设混合溶液体积为两者之和,所得固体体积忽略不计。
(1)若所得混合溶液呈中性,则a:b值为多少?
(2)若a:b=9:2,则所得溶液PH值为多少?
32、(6分)在763k,3.04×104kPa时,用CO和H2做原料合成甲醇(CH3OH),反应为:CO(g)+2H2(g)
![]() CH3OH(g) ,计算并填写下列空白(不要求写出计算过程)
CH3OH(g) ,计算并填写下列空白(不要求写出计算过程)
(1)设H2和CO的起始物质的量之比为m,平衡时CO的转化率为α,平衡混合气中甲醇的体积百分含量为y,则m,α,y三者的关系为 。
(2)已知m, α,y的部分数据,试计算出其它数据填在空格中,并分析反应物的最佳配比应为m= .
| m | α | y |
| 1 | 0.25 | 16.67% |
| 2 | 0.45 | 21.43% |
| 3 | 19.35% |
参考答案
一、选择题(每小题只有1个正确答案,每小题2分,共50分)
1 B 2 B 3 D 4 C 5 D 6 A 7 C 8 A 9 B 10 D 11 B 12 C 13 A 14 B 15 D 16 D 17 C 18 C 19 B 20 A 21 C 22 A 23 C 24 B 25 A
二、填空题
26、(1) 稀硫酸 ;Al2(SO4)3 ; Al3+ +3HCO3-=Al(OH)3↓+ 3CO2↑
(2) ① 6 ② 2c(Na+) = 0.2 mol·L-1 ③ HA酸使弱酸,A-的水解程度大于HA的电离程度
27、(1) 3 Cu2S+ 22 HNO3 = 6 Cu(NO3)2+ 10 NO↑+ 3 H2SO4+ 8 H2O
(2) 2 MnO4-+ 5 H2O2+ 6 H+ = 2 Mn2++ 8 H2O + 5 O2↑
28、(1) O2 ; (2) 20mL (3) 20mL < V < 60mL
29、(1) < ;(2) < (3) C (4) 45 ; 145
30、(1)BDCEAF / ABDCEF ;(2) 防止标准溶液浓度变小 ;(3) 锥形瓶中溶液颜色由无色变成浅红色 ;(4) 偏高
三、计算题(共10分)
31、(4分)(1)10:1;(2)PH=2
32、(6分)(1) y=![]() 。(2) 2 ;.
。(2) 2 ;.
| m | α | y |
| 1 | ||
| 2 | ||
| 3 | 0.56 |