高二化学第一学期月考1试题
一.选择题(每道题目仅有一个选项符合题意共54分)
1.下列三种化合物由左到右是按强电解质、弱电解质、非电解质的顺序排列的一组是
A、HCl、CaCO3、SO2 B、HClO、H2S、C2H5OH
C、KNO3、CH3COOH、NH3 D、BaSO4、H3PO4、H2O
2.对于反应2A(g)+3B(g)=C(g)+5D(g),在某段时间内的平均反应速率为![]() ,(x代表某反应物或生成物)之间的关系,正确的是
,(x代表某反应物或生成物)之间的关系,正确的是
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
3.对室温下pH相同、体积相同的氨水和氢氧化钠溶液分别采取下列措施,有关叙述正确的是
A.加入适量的氯化铵晶体后,两溶液的pH均碱小
B.温度下降10ºC,两溶液的pH均不变
C.分别加水稀释10倍,两溶液的pH仍相等
D.用盐酸中和,消耗的盐酸体积相同
4.下列事实不能说明亚硝酸(HNO2)是弱酸的是
A、HNO2不与NaCl反应
B、HNO2与同浓度的盐酸溶液作对比导电实验,灯泡很暗
C、室温下NaNO2溶液的pH值大于7
D、室温下0.1 mol /L HNO2溶液的pH = 2.1
5.在一定温度下,向a L密闭容器中加入1mol X气体和2 mol Y气体,发生如下反应:
X(g)+2Y(g)![]() 2Z(g)此反应达到平衡的标志是
2Z(g)此反应达到平衡的标志是
A 容器内密度不随时间变化
B 容器内各物质的浓度不随时间变化
C 容器内X、Y、Z的浓度之比为1︰2︰2
D 单位时间消耗0.1mol X同时生成0.2mol Z
6.下列说法中,不正确的是
A.在0.1mol•L-1的氢溴酸中加入适量的蒸馏水,溶液的c(H+)减小
B.在由水电离出的c(OH-)=1×10-12mol•L-1的溶液中,Al3+不可能大量存在
C.室温下,CH3COOH分子可以存在于pH=8的碱性溶液中
D.在NH4Cl溶液中,加入Mg(OH)2固体可被溶解
7. 在合成氨时下列可以提高H2转化率的措施是
A.延长反应时间 B.充入过量的H2 C.充入过量的N2 D.升高温度
8.t℃时,水的离子积为Kw,该温度下将amol·L-1,一元酸HA与 bmol·L-1一元碱 BOH等体积混合,要使混合液呈中性,必要的条件是( )
A.混合液的pH=7 B.混合液中,c(H+)=
C.a=b D.混合液中,c(B+)=c(A-)+c(OH-)
9.常温下,![]() 相等的盐酸和醋酸中的
相等的盐酸和醋酸中的![]()
A. 前者大 B. 后者大 C. 相等 D. 无法确定
![]() 10.反应C(s)+H2O(g) CO(g)+ H2(g)在一可变容积的密闭容器中进行,在其它条件不变的情况下,下列条件的改变对其反应速率几乎无影响的是
10.反应C(s)+H2O(g) CO(g)+ H2(g)在一可变容积的密闭容器中进行,在其它条件不变的情况下,下列条件的改变对其反应速率几乎无影响的是
A、增加CO的物质的量
B、将容器的体积缩小一半
C、保持体积不变,充入N2使体系压强增大
D、保持压强不变,充入N2使容器体积变大
11.在一密闭烧瓶中,在25℃时存在着平衡:2NO2![]() N2O4
;(正反应放热)把烧瓶置于100℃的水中,则下列几项性质中不会改变的是 ①颜色 ②平均分子量 ③质量 ④压强 ⑤密度
N2O4
;(正反应放热)把烧瓶置于100℃的水中,则下列几项性质中不会改变的是 ①颜色 ②平均分子量 ③质量 ④压强 ⑤密度
A、 ①和③ B、 ②和④ C、 ④和⑤ D、 ③和⑤
12.在一定条件下,将![]() 和
和![]() 充入一个容积固定的密闭容器中,发生反应
充入一个容积固定的密闭容器中,发生反应![]()
![]()
![]() .当反应达到平衡时
.当反应达到平衡时![]() 为n mol.在与上述完全相同的容器中,保持温度不变,若平衡时
为n mol.在与上述完全相同的容器中,保持温度不变,若平衡时![]() 仍为n mol,则下列组合中不正确的是
仍为n mol,则下列组合中不正确的是
| 起始状态/mol | ||
|
|
|
|
| A.2 | 0 | 2 |
| B.2.5 | 1.5 | 1 |
| C. | 2 |
|
| D.0 | 0 | 2 |
13.相同温度下,100mL 0.01mol/L的醋酸溶液与10mL 0.1mol/L的醋酸溶液相比较,下列数值前者大于后者的是
A.c (CH3COO-) B. c (H+)
C.c (CH3COOH) D. c (OH-)
14.为了使Na2S溶液中[Na+]/[S2-]的比值变小,可加入的物质是
A、适量盐酸 B、适量NaOH溶液
C、适量KOH溶液 D、适量H2O
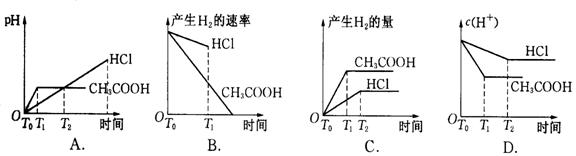
15.在体积都为1 L,pH都等于2的盐酸和醋酸溶液中,投入0.65 g锌粒,则下图所示比较符合客观事实的是
16.将1mol H2(g)和2mol I2(g)置于某2L密闭容器中,在一定温度下发生反应:H2(g)+ I2(g) ![]() 2HI(g) (正反应放热);并达到平衡。HI的体积分数ω(HI)随时间变化如图(Ⅱ)所示,
2HI(g) (正反应放热);并达到平衡。HI的体积分数ω(HI)随时间变化如图(Ⅱ)所示,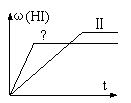 若改变反应条件,ω(HI)的变化曲线如图(Ⅰ)所示,则改变的条件可能是
若改变反应条件,ω(HI)的变化曲线如图(Ⅰ)所示,则改变的条件可能是
A、恒容条件下升高温度
B、恒温条件下,缩小反应容器体积
C、恒温恒容条件下,加入适当催化剂
D、恒温条件下,扩大反应容器体积
17.0.1mol/LNa2CO3溶液中,由于CO32-的水解,使得c(CO32-)<0.1mol/L。如果要使则c(CO32-)更接近与0.1mol/L,可以采取得措施是
A.加少量得盐酸 B.加入适量的水
C.加入适量的KOH D.加热
18.已知在常温下溶液中的pH+pOH=14,又知正常人(人的体温高于室温)的血液的pH=7.3。则正常人血液的pOH是
A.大于6.7 B.小于6.7 C.等于6.7 D. 无法判断
二.填空题(共36分)
19.相同条件,等物质的量浓度的下列六种溶液:①NaHCO3②NaClO ③Na2SO4④NaHSO4⑤NaOH⑥(NH4)2SO4等溶液,PH值由大到小的顺序为:
20.(1)0.020 mol/L的HCN(aq)与0.020 mol/L NaCN(aq)等体积混合,已知该混合溶液中C(Na+) > C(CN-),用“>、<、=”符号填空
①溶液中c(OH -) c(H +) ② c (HCN) c(CN - )
(2)向碳酸钠的浓溶液中逐滴加入稀盐酸,直到不再生成二氧化碳气体为止,则在此过程中,溶液的碳酸氢根离子浓度变化趋势可能是: (A) 逐渐减小; (B) 逐渐增大; (C) 先逐渐增大,而后减小; (D) 先逐渐减小,而后增大. 你的选择是
(3)pH值相同的 ①HCl(aq)、 ②H2SO4(aq)、 ③ CH3COOH(aq)各100 mL
①三种溶液中物质的量浓度最大的是 。
②分别加入等体积0.1 mol/L的NaOH(aq),则反应开始瞬间,反应速率 。
A、HCl最快 B、H2SO4最快 C、CH3COOH最快 D、一样快
(4)某温度下,纯水中的c(H+) = 2.0×10-7 mol/L,则此时c(OH-) = mol/L。若温度不变,滴入稀盐酸使c(H+)=5.0×10-6 mol/L,则c(OH-) = mol/L。
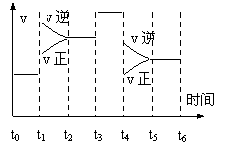 21.一密闭容器中发生下列反应N2+3H2
21.一密闭容器中发生下列反应N2+3H2![]() 2NH3;(正反应放热),下图是某一时间段中反应速率与反应进程的曲线关系图。回答下列问题:
2NH3;(正反应放热),下图是某一时间段中反应速率与反应进程的曲线关系图。回答下列问题:
(1)处于平衡状态的时间段是_______ ______
(2)t1、t3、t4时刻,体系中分别是什么条件发生了
变化?
______________________ 、______________________、 ____________________。
(3)下列时间段中,氨的百分含量最高的是( )
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
22.用实验确定某酸HA是弱电解质。两同学的方案如下:
甲:①称取一定质量的HA配制0.1 mol·L-1的溶液100mL;
②用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100 mL;
②分别取这两种溶液各10 mL,加水稀释为100mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用的定量仪器是 。
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH 1(选填“>”“<”“=”)
乙方案中,说明HA是弱电解质的现象是 (多选扣分)
a.装HCl溶液的试管中放出H2的速率快;
b.装HA溶液的试管中放出H2的速率快;
c.两个试管中产生气体速率一样快。
(3)请你评价:乙方案中难以实现之处
。
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作扼要表述。
三.计算题(共10分)
![]() 23.(6分)对于反应2L(g)+3M(g) XQ(g)+3R(g),在容积为2L的密闭容器中,将2mol气体L和3mol气体M混合,当反应经2分钟后达平衡时,生成2.4mol气体R,并测得Q的浓度为0.4mol/L。
23.(6分)对于反应2L(g)+3M(g) XQ(g)+3R(g),在容积为2L的密闭容器中,将2mol气体L和3mol气体M混合,当反应经2分钟后达平衡时,生成2.4mol气体R,并测得Q的浓度为0.4mol/L。
(1) x的值是_________
(2) L的转化率为_________(3) M的反应速率![]() 为____________
为____________
24.(4分)将pH=3的H2SO4与pH=12的NaOH混合,当混合溶液pH=10时,则H2SO4溶液和NaOH溶液的体积比是多少?
化学答案卡
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
19._____________________________
20.(1) ①____ ②_____ (2)______
(3)①________ ② _______
(4)c(OH-) = mol/L;c(OH-) = mol/L。
21(1)_________________________
(2)______ ;_________;________
(3)______
22(1)__________ (2)______;_____
(3)_________________________
(4)___________________________________________________________
23. (1) _____ (2) _____ (3) _________
24
参考答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| C | D | A | A | B | B | C | B | C | C | D | D | D | C | C | A | C | B |
19.⑤②①③⑥④
20.(1)① > ② > (2) C
(3)① ③ ② D
(4)2.0×10-7 ; ② 8.0×10-9 。
21. t0~t1 t2~t3 t3~t4 t5~t6
升高温度 ;加入催化剂 ; 降低压强 ; A
22. (1)100 mL容量瓶(注:未标明规格的扣1分)
(2)> ; b(多选扣分)
(3)配制pH=1的HA溶液难以实现
(4)配制NaA溶液,室温下测其pH>7即证明HA是弱电解质。
23. (1) 1 (2) 80% (3) 0.6molL-1min_1
24. V(H2SO4)∶V(NaOH)= 9∶1