高二化学期末模拟试题(一)
一、选择题(每小题只有一个正确答案,每小题3分,本题共60分)
1、下列物质的水溶液能导电,但属于非电解质的是( )
A.CH3CH2COOH B.Cl2 C.NH4HCO3 D.SO2
2、下列实验中用错试剂的是
A.用稀盐酸清洗做焰色反应的镍铬丝 B.用酒精萃取碘水中的碘
C.用稀硝酸洗去试管壁上的银镜 D.用碱石灰吸收氨气中的水蒸气
3.煅烧硫铁矿石(主要成分是FeS2),可获得制取硫酸所需的SO2,反应方程式为:
4FeS2 + 11O2 = 2Fe2O3 + 8SO2,为了提高SO2的生成速率,下列措施可行的 ( )
A.增加硫铁矿石的投入量 B.增加炉的高度
C.降低温度 D.升高温度
|
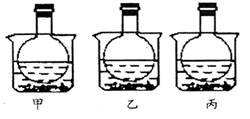
A.甲烧瓶中气体颜色变浅
B.乙烧瓶中气体颜色变深
C.丙烧瓶中气体压强明显增大
D.上述三种说法都不正确
![]() 5.在容积为2L的密闭容器中,有反应:mA (g) + nB (g) pC (g) + qD (g),经过5分钟达到平衡,此时各物质的变化为A减少为a mol /L,B的平均反应速率VB = a/15 mol/ (L min),C增加2a
/ 3 mol/L,这时若增加系统压强,发现A与C的百分含量不变,则m:n:p:q为( )A.3:1:2:2 B.1:3:2:2 C.1:3:2:1 D.1:1:1:1
5.在容积为2L的密闭容器中,有反应:mA (g) + nB (g) pC (g) + qD (g),经过5分钟达到平衡,此时各物质的变化为A减少为a mol /L,B的平均反应速率VB = a/15 mol/ (L min),C增加2a
/ 3 mol/L,这时若增加系统压强,发现A与C的百分含量不变,则m:n:p:q为( )A.3:1:2:2 B.1:3:2:2 C.1:3:2:1 D.1:1:1:1
6.下列变化规律不正确的是 ( )
A.温度升高,水的电离平衡向右移动 B.加水稀释时,醋酸钠的水解平衡向左移动
C.增大压强,对醋酸的电离平衡影响不大
D.向氯化铁溶液中加入氧化钠,水解平衡向右移动
7、绿色化学提倡化工生产应提高原子利用率。原子利用率表示目标产物的质量与生成物总质量之比。在下列制备环氧乙烷的反应中,原子利用率最高的是( )
![]() A.
A.
![]() B.
B.
![]() C.
C.
![]() D.
D.
8.等物质的量浓度的下列溶液中,NH4+离子的浓度最大的( )
A.NH4Cl B.NH4HCO3 C.NH4HSO4 D.NH4NO3
|
10.pH值为4的FeCl3溶液和pH值为10的K2CO3溶液中,水的电离程度分别为α1和α2,则它们的大小关系( )
A.α1>α2 B.α1<α2 C.α1=α2 D.无法判断
11、下列变化规律中正确的是
A.H2S,HCl,PH3的热稳定性由弱到强
B.物质的量浓度相等的NaCl,MgCl2,AlCl3三种溶液的pH由小到大
C.等质量的甲烷、乙烯、乙炔充分燃烧,所耗用氧气的量由少到多
D.![]() ,
,![]() ,
,![]() 的酸性由弱到强
的酸性由弱到强
12.下列各组离子在溶液中可以大量共存的是 ( )
A.K+、Ca2+、HCO3-、CH3COO- B.酸性溶液中:I-、Cl-、Ba2+、Fe3+
C.水电离出的H+浓度为1×10-14mol·L-1的溶液中:I-、NO3-、K+、Mg2+
|
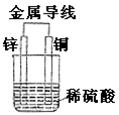
13.关于如右图所示装置的叙述,正确的是( )
A.此装置为原电池,铜片上有气泡产生
B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片
D.氢离子在铜片表面被氧化
14.向10mL pH = 2的NaOH溶液中加入10 mL某酸,再滴入几滴甲基橙,则溶液呈红色。这种酸可能是 ( )
A.pH = 2的硫酸 B.pH = 2的醋酸 C.0.01 mol/L甲酸 D.0.01 mol/L硝酸
15.草酸是二元弱酸,草酸氢钾溶液呈酸性。在0.01 mol·L-1KHC2O4溶液中,下列关系正确的是 ( )
A.c (K+) + c (H+) = c (HC2O4-) + c (OH-) + c (C2O42-)
B.c (HC2O4-) + c (C2O42-) = 0.1 mol·L-1
C.c (C2O42-) < c (H2C2O4)
D.c (K+) = c (H2C2O4) + c (HC2O4-) + c (C2O42-)
16.现有溶液中溶质的物质的量浓度均为0.01 mol·L-1的四种溶液:①盐酸,②硫酸,③醋酸,④NaOH,下列说法正确的是( )
A.pH由小到大的顺序是①< ②< ③< ④
B.溶液中水电离出的H+浓度由小到大的顺序是②<①<④<③
C.取一定体积的④溶液,分别和①、②、③溶液完全中和,消耗①、②、③溶液的体积由小到大的顺序是②<①<③
D.取a体积的①溶液和b体积的④溶液混合后,溶液的pH为3,则a:b约为11:9
![]() 17.在一个固定容积的密闭容器中,放入3升X(气)和2升Y(气),在一定条件下发生下列反应:4X (g) + 3Y (g) 2Q (g) + nR (g),达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,X的浓度减小1/3,则该反应方程式中的n值( )
17.在一个固定容积的密闭容器中,放入3升X(气)和2升Y(气),在一定条件下发生下列反应:4X (g) + 3Y (g) 2Q (g) + nR (g),达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,X的浓度减小1/3,则该反应方程式中的n值( )
A.4 B.5 C.6 D.7
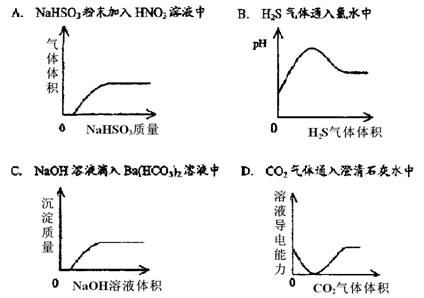
18、向下列溶液中通入过量CO2,最终出现浑浊的是
A.氢氧化钙饱和溶液 B.苯酚钠饱和溶液
C.醋酸钠饱和溶液 D.氯化钙饱和溶液
19.某有机物在酸性条件下发生水解反应时,生成两种不同有机物,且这两种有机物的相对分子质量相等。则水解前的这种有机物是 ( )
A.甲酸甲酯 B.乙酸异丙酯 C.麦芽糖 D.葡萄糖
20、在相同温度时100 mL 0.01mol/L的醋酸溶液与10 mL 0.1mol/L的醋酸溶液相比较,下列数值前者大于后者的是
A.中和时所需NaOH的量 B.电离程度
C.H+的物质的量的量浓度 D.CH3COOH的物质的量
二、填空题(本题共40分)
21.在25℃时,若100体积的某强酸以溶液与1体积的某强碱溶液混合后溶液呈中性,则混和之前,该强酸pH值与强碱pH值之间应满足的关系是的 。
22.某地的酸雨中,含c (Na+) = 7.0×10-6mol/L,c (Cl-) = 4.5×10-5 mol/L,c (NH4+) = 2.3×10-5 mol/L,c (SO42-) = 2.5×10-6 mol/L,则该地酸雨的pH约为 。.
23.下列说法是否正确?为什么?
(1)NH3在碱性溶液中比在纯水的溶解度大。
(2)氯化钠和醋酸铵的pH都接近于7,因此它们都没有发生水解。
![]() 24.在一恒定容积的容器中充入2 molA和1molB发生反应:2A(g) + B(g) xC(g)达到平衡后,C的体积分数为W%。若维持容积和温度不变,按1.4 molA、0.7molB、1.2molC为起始物质,达到平衡后C的体积分数仍为W%,则x的值为:
24.在一恒定容积的容器中充入2 molA和1molB发生反应:2A(g) + B(g) xC(g)达到平衡后,C的体积分数为W%。若维持容积和温度不变,按1.4 molA、0.7molB、1.2molC为起始物质,达到平衡后C的体积分数仍为W%,则x的值为:
25.从废液FeCl3、FeCl2、CuCl2中回收Cu,同学们设计了如下方案:废液中加入过量的铁粉,过滤,向铁、铜混合物中加入足量的盐酸,过滤后得到铜。上述过程中发生的所有反应的离子方程式为:
这些反应所涉及的四种阳离子的氧化性顺序由大到小为
26.用实验确定某酸HB的弱电解质。两同学的方案是:
甲:①称取一定质量的HB配制0.1mol/L的溶液100mL;
②用pH试纸测出该溶液的pH值,即可证明HB是弱电解质。
乙:①用已知物质的量浓度的HB溶液、盐酸,分别配制pH = 1的两种酸溶液各100mL;
②分别取这两种溶液各10mL,加水稀释为100mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HB是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是
(2)甲方案中,说明HB是弱电解质的理由是测得溶液的pH 1(选填>、<、=)
乙方案中,说明HB是弱电解质的现象是 (多选扣分)
A.HCl溶液的试管中放出H2的速率快; B.装HB溶液的试管中放出H2的速率快;
C.两个试管中产生气体速率一样快。
(3)请你评价:乙方案中两个难以实现之处
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表达。
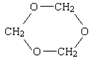
27.分子式为C3H6O3的物质有多种同分异构体,请写出符合下列要求的各种同分异构体的结构简式。
说明:①不考虑同一碳原子上连两个羟基;②乙炔、苯等分子中同类原子化学环境相同,丙烷、丁烷等分子中同类原子化学环境有两种。
(1)甲分子中没有甲基,且1mol甲与足量金属Na反应生成1molH2。若甲还能与NaHCO3溶液反应,则甲的结构简式为 ;若甲还能发生银镜反应,则甲的结构简式为 。
(2)乙分子中所有同类原子的化学环境相同,且不与金属Na反应,则乙结构简式为 。
(3)丙分子中碳与氧分别有两种化学环境,氢的化学环境相同,且丙与金属Na不反应,则丙结构简式为 。
参考答案
一、选择题(每小题只有一个正确答案,本题共60分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| D | B | D | D | A | B | C | C | D | C |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| D | A | A | B | D | D | C | B | B | B |
二、填空题(本题共40分)
21.强酸的pH值与强碱的pH值之和等于16
22.4.7
23.(1)不正确。NH3溶于水,存在溶解平衡、化学平衡和电离平衡:
![]()
![]()
![]() NH3 (g) NH3 (aq);NH3 + H2O NH3·H2O NH4+
+ OH-
NH3 (g) NH3 (aq);NH3 + H2O NH3·H2O NH4+
+ OH-
碱性溶液中c (OH-)较大,会促使上述平衡逆向移动,使得NH3的溶解度下降。
(2)不正确。氯化钠pH接近于7,是因为Na+、Cl-不影响水的电离;没有发生水解。而醋酸铵的pH接近于7,是因为CH3COO-、NH4+都发生了水解,只是水解程度几乎相同。
24.3或4
25. 2Fe3+ + Fe = 3Fe2+, Fe + Cu2+ = Cu + Fe2+,
Fe + 2H+ = Fe2+ + H2↑; Fe3+ > Cu2+ > H+ > Fe2+
26.(1)100mL容量瓶 (2)> B
(3)配制pH =1的HB溶液难以实现;加入的锌粒难以做到表面积相同
(4)配制NaB溶液,测其pH值>7即证明HB是弱电解质
 (注:本题解答若操作简单、现象明显、不是化学教材中讲过的常规方法应属创新,经认可后可得分)
(注:本题解答若操作简单、现象明显、不是化学教材中讲过的常规方法应属创新,经认可后可得分)
27.(8分)(1)HOCH2CH2COOH (2) (3)CH3OCOOCH3
HOCH2CHOHCHO