高二化学选修三专题4分子空间结构与物质性质
单 元 测 试 题
可能用到的相对原子质量: H: 1 C:12 N: 14 O: 16 Na:23 Mg: 24
Al:27 Cl: 35.5 Fe:56 Cu: 64 Zn: 65
第 Ⅰ 卷(选择题 共63分)
一、 选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意)
1.石墨晶体是层状结构,在每一层里,每一个碳原子都跟其它3个碳原子相结合。
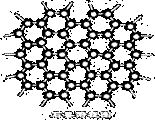 下图是石墨的晶体结构俯视图,图中每个黑点表示1个碳原子,而两黑点间的连线表示1个共价键,则石墨晶体中碳原子个数与共价键个数之比为
( )
下图是石墨的晶体结构俯视图,图中每个黑点表示1个碳原子,而两黑点间的连线表示1个共价键,则石墨晶体中碳原子个数与共价键个数之比为
( )
A.1:3 B.2:3
C.2:1 D.3:2
2。S轨道与p轨道杂化的类型不可能有 ( )
A、sp B、sp2 C、sp3 D、sp4
3.有关乙炔分子中的化学键描述不正确的是 ( )
A.两个碳原子采用sp杂化方式
B.两个碳原子采用sp2杂化方式
C.每个碳原子都有两个未杂化的2p轨道形成π键
D.两个碳原子形成两个π键
4.膦(PH3)又称磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中常含有磷化氢。它的分子构型是三角锥形。以下关于PH3的叙述正确的是 ( )
A.PH3分子中有未成键的孤对电子 B.PH3是非极性分子
C.PH3是一种强氧化剂 D.PH3分子的P-H键是非极性键
5.下列物质中,难溶于CCl4的是 ( )
A.碘单质 B. 水 C. 苯 D.甲烷
6.下列事实中能证明氯化氢是共价化合物的是 ( )
A.液态氯化氢不导电 B.氯化氢极易溶于水
C.氯化氢不易分解 D.氯化氢溶液可以电离
7.下列事实与氢键有关的是 ( )
A.水加热到很高的温度都难以分解 B.水结冰成体积膨胀,密度减少
C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增加而升高
D.HF、HCI、HBr、HI的热稳定性依次减弱
8、下列分子中,结构构成平面三角形的是( )
A、HgCl2 B、H2O C、CCl4 D、SF6
二、选择题(本题包括13小题,每小题3分,共39分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
9.与NH4+互为等电子体的分子是
A.H3O+ B.OH- C.NH3 D.CH4
10.下列分子或离子中,含有孤对电子的是 ( )
A.H2O B.CH4 C.SiH4 D.NH4+
11.氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为 ( )
A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化。
B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道。
C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。
D.氨气分子是极性分子而甲烷是非极性分子。
12.在乙烯分子中有5个σ键、一个π键,它们分别是 ( )
A.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键
B.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键
C.C-H之间是sp2形成的σ键,C-C之间未参加杂化的2p轨道形成的是π键
D.C-C之间是sp2形成的σ键,C-H之间是未参加杂化的2p轨道形成的π键
13、在[Co(NH3)5Cl]Cl2中,内界是( )
A、Co(NH3)5 B、Co(NH3)5Cl C、Co D、Cl-
14、下列配合物的配位数不是6的是( )
A、K2[Co(NCS)4] B、Na2[SiF6] C、Na3[AlF6] D、[Cu(NH3)4]Cl2
15、已知Zn2+的4s轨道和4p轨道可以形成sp3型杂化轨道,那么[ZnCl4]2-的空间构型为
A、直线形式上 B、平面正方形 C、正四面体形 D、正八面体形
16、下列物质不能溶于浓氨水的是( )
A、AgCl B、Cu(OH)2 C、AgOH D、Fe(OH)3
17.最近,中国科大的科学家们将C60分子组装在一单层分子膜表面,在—268℃时冻结分子的热振荡,并利用扫描隧道显微镜首次“拍摄”到能清楚分辨碳原子间单、双键的分子图像。下列化合物分子中一定既含单键又含双键的是 ( )
A.CO2 B.C2H4O C.COCl2 D.H2O2
18.有关苯分子中的化学键描述正确的是 ( )
A.每个碳原子的sp2杂化轨道中的其中一个形成大π键
B.每个碳原子的未参加杂化的2p轨道形成大π键
C.碳原子的三个sp2杂化轨道与其它形成三个σ键
D.碳原子的未参加杂化的2p轨道与其它形成σ键
19.下列各组分子中,都属于含极性键的非极性分子的是 ( )
A. CO2 H2S B. C2H4 CH4
C. C60 C2H4 D.NH3 HCl
20.三氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120o,它能水解,有关叙述正确的是 ( )
A.三氯化硼液态时能导电而固态时不导电 B.三氯化硼加到水中使溶液的pH升高
C.三氯化硼分子呈正三角形,属非极性分子 D.三氯化硼遇水蒸气会产生白雾
21.关于氢键,下列说法正确的是 ( )
A.每一个水分子内含有两个氢键 B.冰、水和水蒸气中都存在氢键
C.DNA中的碱基互补配对是通过氢键来实现的
D.H2O是一种非常稳定的化合物,这是由于氢键所致
第 Ⅱ 卷(非选择题 共57分)
考试时间:100分钟 卷面分数:120分 命题人:王启迪
班级 姓名 学号 得分
(请将选择题的答案填入下表)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | |
| 答案 | |||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 |
| 答案 |
三、(本题包括6小题,共57分)
22..(12分)1919年,Langmuir提出等电子原理:原子数相同、电子总数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近。
(1)根据上述原理,仅由第2周期元素组成的共价分子中,互为等电子体的是:
和 ; 和 。
(2)此后,等电子原理又有所发展。例如,由短周期元素组成的微粒,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征。在短周期元素组成的物质中,与NO2—互为等电子体的分子有: 、 。
23.(7分)溴化碘(IBr)的化学性质类似于卤素单质,试回答下列问题:
(1)溴化碘的电子式是 ,它是由 键形成的 分子。
(2)溴化碘和水反应生成了一种三原子分子,该分子的电子式为 。
24.(10分)(1)、试用杂化轨道理论分析为什么BF3的空间构型是平面三角形,而NF3是三角锥形的?
(2)、果糖分子的结构简式为CH2OH(CHOH)3COCH2OH,试写出其结构式。并用*标记出其中的手性碳原子;在果糖分子中C原子以何种杂化轨道成键?成何种键?
25.(8分)用“>”或“<”完成下列填空。
⑴键的极性:H—C H—N。 ⑵键角:C2H4 CH4
⑶分子中σ键数目:C2H4 CH4 ⑷分子中π键数目:C2H4 C2H2
26.(12分)(1)、在N2、NH3、NH4+、H2O、H3O+、ICl、SO42-中,含有配位键的微粒有 ;
(2)、利用价层电子对数判断分子的空间构型的方法判断如下:CO32-、SO32-、NO2和ClO4-的空间构型分别为 、 、 、和 、
27、(8分)写出下列化学方程式(或离子方程式):
⑴、在氯化锌溶液中加入过量的氨水
⑵、在硫酸铜溶液中加入过量的浓氨水
下面两个写离子方程式:
⑶、氯化银溶于浓氨水
⑷、在FeCl3溶液中加入过量的氨水
参考答案:
(请将选择题的答案填入下表)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | |
| 答案 | B | D | B | A | B | A | B | B | D | A | |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 |
| 答案 | C | A、C | B | A、D | C | D | C | B、C | B | C、D | C |
三、(本题包括6小题,共57分)
22..(12分)1919年,Langmuir提出等电子原理:原子数相同、电子总数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近。
(1)根据上述原理,仅由第2周期元素组成的共价分子中,互为等电子体的是:
CO 和 N2 ; CO2 和 N2O 。
(2)此后,等电子原理又有所发展。例如,由短周期元素组成的微粒,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征。在短周期元素组成的物质中,与NO2—互为等电子体的分子有: O3 、 SO2 。
![]() 23.(7分)溴化碘(IBr)的化学性质类似于卤素单质,试回答下列问题:
23.(7分)溴化碘(IBr)的化学性质类似于卤素单质,试回答下列问题:
![]() (1)溴化碘的电子式是
,它是由 极性 键形成的 极性 分子。
(1)溴化碘的电子式是
,它是由 极性 键形成的 极性 分子。
(2)溴化碘和水反应生成了一种三原子分子,该分子的电子式为 。
24.(10分)(1)、试用杂化轨道理论分析为什么BF3的空间构型是平面三角形,而NF3是三角锥形的?
答:B原子的2s轨道上的一个电子受激发跃迁到2p轨道上,在F原子的作用下发生了sp2杂化。与三个F原子形成三个σ键。故是平面三角形。而在NF3分子中N原子发生了sp3杂化形成四个sp3杂化轨道,其中有一对孤对电子占据一个轨道。另三个轨道与三个F形成三个σ键,故是三角锥形。
(2)、果糖分子的结构简式为CH2OH(CHOH)3COCH2OH,试写出其结构式。并用*标记出其中的手性碳原子;在果糖分子中C原子以何种杂化轨道成键?成何种键?
H H H H H
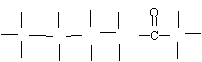
![]() H C* C* C*
C*
C H
H C* C* C*
C*
C H
OH OH OH OH OH
其中 中的碳原子是以sp2杂化形成3个σ键和一个π键,而其余的5个碳原子都是以sp3杂化形成4个σ键。
25.(8分)用“>”或“<”完成下列填空。
⑴键的极性:H—C < H—N。 ⑵键角:C2H4 > CH4
⑶分子中σ键数目:C2H4 > CH4 ⑷分子中π键数目:C2H4 < C2H2
26.(12分)(1)、在N2、NH3、NH4+、H2O、H3O+、ICl、SO42-中,含有配位键的微粒有 NH4+ 、H2O、H3O+、 SO42- ;
(2)、利用价层电子对数判断分子的空间构型的方法判断如下:CO32-、SO32-、NO2和ClO4-的空间构型分别为 平面三角形 、 三角锥形 、 V形 、和 正四面体 、
27、(8分)写出下列化学方程式(或离子方程式):
⑴、在氯化锌溶液中加入过量的氨水 ZnCl2+4NH3=[Zn(NH3)4]Cl2
⑵、在硫酸铜溶液中加入过量的浓氨水 CuSO4+4NH3=[Cu(NH3)4]SO4
下面两个写离子方程式:
⑶、氯化银溶于浓氨水 AgCl+2NH3·H2O=[Ag(NH3)2]Cl+2H2O
⑷、在FeCl3溶液中加入过量的氨水 Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+