高二化学学科学业水平测试
模拟试卷
考试说明:
1.全卷满分为100分,考试时间为75分钟.
2.可能用到的元素的相对原子质量: H-1,C-12,O-16,N-14,Ca-40, Mg-24 , S-32,
Fe-56, Cl-35.5,Na-23, K-39, Cu-64 Ba-137
第Ⅰ卷(选择题 共69分)
选择题的答案请涂在第II卷的表格中.
一、选择题(本题包括17小题,每小题3分,共51分.每小题只有一个选项符合题意)
1.据统计,世界上的古建筑在20世纪所遭受的腐蚀比过去几百年甚至几千年所遭受的腐蚀还要严重,这是因为
A.古建筑的腐蚀是可逆过程,在前几百年甚至几千年前处于化学平衡状态,而近几十年来腐蚀向正反应方向移动
B.由于近几十年来大量使用矿石燃料,造成酸雨,加速了古建筑的腐蚀
C.由于近几十年来参观的人数急剧增多,加速了古建筑的磨损
D.由于近几十年来温室效应加剧,加速了古建筑的风化
2.下列物质的水溶液能导电,但该物质属于非电解质的是
A.CuSO4 B.CO2 C.HCl D.CH3CH2OH
3.实验中的下列操作正确的是
A.用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,把过量的试剂倒入试剂瓶中
B.用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中
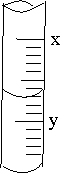 C.用蒸发结晶的方法使NaCl从溶液中析出,应将蒸发皿中NaCl溶液全部蒸干才停止加热
C.用蒸发结晶的方法使NaCl从溶液中析出,应将蒸发皿中NaCl溶液全部蒸干才停止加热
D.分液操作时,分液漏斗中下层液体从上口放出,上层液体从下口倒出
4.右图是10ml量筒的一部分,数字X、Y之间相差1ml.若X=5,则量筒所盛液体的体积是
A. 5.7 ml B. 4.4 ml C. 4.3 ml D. 6.3 ml
5.将铁的化合物溶于盐酸,滴加KSCN溶液不发生颜色变化,再加入适量氯水,
溶液立即呈红色的是
A.Fe2O3 B.FeCl3 C.Fe2(SO4)3 D.FeO
6.下列说法正确的是
A.1H、2H、3H互为同素异形体 B.O2、O3互为同位素
C.丁烷和2-甲基丙烷互为同分异构体 D.乙烷、乙烯互为同系物
7.下列化学用语的书写,正确的是
A.氮气的电子式:![]() B.硫原子的结构示意图:
B.硫原子的结构示意图: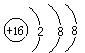
C.溴化钠的电子式: ![]() D.水分子的结构式:
D.水分子的结构式:![]()
8.若NA代表阿伏加德罗常数,下列说法正确的是
A.1个标准大气压、20℃下,11.2LN2含有的分子数为0.5NA
B.4℃时9mL水和标准状况下11.2L氮气含有相同的分子数
C.同温同压下,NA个NO与NA个N2和O2的混合气体的体积不相等
D.常温常压下,11.2 L氧气所含的原子数目为NA
9.下列反应的离子方程式正确的是
A.铝片跟氢氧化钠溶液反应:Al+2OH-=AlO2-+H2↑
B.硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓
C.碳酸钙跟醋酸反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑
D.铜片跟稀硝酸反应:Cu+NO3-+4H+=Cu2++NO↑+2H2O
10.在强酸性溶液中能大量共存的无色透明的离子组是
A.Al3+、Cu2+、NO3—、Cl— B.Na+、NO3—、SO42—、Fe2+
C.Mg2+、NH4+、SO42—、Cl— D.Ba2+、K+、CO32—、Cl—
11.只用一种试剂就能把AlCl3、Mg SO4、(NH4)2SO4、NH4Cl四种溶液区分开来,这种试剂是
A.AgNO3 B.BaCl2 C.NaOH D.Ba(OH)2
12.在下列三个反应中,过氧化氢(H2O2)所起的作用是
|
A.均起氧化剂作用 B.均起还原剂作用 C.相同作用 D.起不同作用
13.下列各组顺序的排列不正确的是
A.原子半径:Na<Mg<Al<F
B.热稳定性:HCl>H2S>PH3>AsH3
C.酸性强弱:H3AlO3<H2SiO3<H2CO3<H3PO4
D.碱性强弱:KOH>NaOH>Mg(OH)2>Al(OH)3
14.一种常见药物的相对分子质量为180,含C、H、O三种元素,其中含C、H的质量分数分别为60℅、4.5℅,所以该药物的分子式为
A. C9H8O4 B.C10H22O3 C.C9H10O4 D. C10H9O4
15.下列装置能够组成原电池的是
![]()
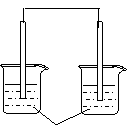

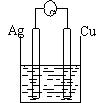

稀硫酸 AgNO3(aq) 蔗糖 稀硫酸
A B C D
16.哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖.现向一密闭容器中充入1mol N2和3mol H2,在一定条件下使该反应发生.下列有关说法正确的是
A.达到化学平衡时,N2将完全转化为NH3
B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C.达到化学平衡时,正反应和逆反应的速率都为零
D.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
17.某有机物的结构简式为CH2=CH—![]() CH2OH.下列关于该有机物的叙述不正确的是
CH2OH.下列关于该有机物的叙述不正确的是
A.能与金属钠发生反应并放出氢气 B.能在催化剂作用下与H2发生加成反应
C.在浓H2SO4催化下能与乙酸发生酯化反应 D.能发生银境反应
二、选择题(本题包括6小题,每小题3分,共18分.每小题只有一个选项符合题意)
18.下列与人的生理有关的叙述中,不正确的是
A.脂肪在人体内代谢的最终产物是CO2和H2O
B.剧烈运动时人体代谢加快,代谢产物不能及时排出,血液的pH增大
C.人体中共有二十几种氨基酸,它们不能都由人体自身合成
D.煤气中毒主要是CO与血红蛋白牢固结合,使血红蛋白失去输氧能力
19.治理太湖污染是我国目前重要的环保工程,措施之一是在太湖流域推广使用无磷洗衣粉,这是继无氟冰箱、无铅汽油推广以来又一重要“绿色化工产品”,下列关于磷污染说法正确的是
A.磷是营养元素,促进鱼类大量繁殖 B.磷是有毒物质,杀死水中的动植物
C.磷导致藻类疯长,鱼类因缺氧而无法生存 D.磷促进水中动植物尸体的分解
20.下列说法错误的是
A.在豆浆中加少量石膏,能使豆浆凝结为豆腐 B.棉花的主要成分是纤维素
C.用灼烧的方法可鉴别毛织物和棉织物 D.温度越高,酶对某些化学反应的催化效率越高
21.为了使天空更蓝、空气更清新,目前江苏的各城市对没有申领到“绿色”通行证的高污染车实行限行.高污染车排出的尾气中所含的污染物除碳氢化合物、可吸入颗粒物、一氧化碳外,还主要含有
A.二氧化碳 B.氮氧化物 C.水蒸汽 D.氮气
22.在面盆、痰盂等铁制品表面烧制搪瓷的目的是
A.防止铁生锈且美观 B.增大厚度防止磨损
C.增大硬度防止撞坏 D.美观和杀菌消毒作用
23.有一张照片,一只可爱的小猫站在一块高分子合成材料上,下面是烈火灼烧,而小猫却若无其事.这说明此高分子材料一定具有的性质是
A.良好的导热性 B.良好的绝缘性 C.良好绝热性 D.熔点低
![]()
 化学答题卷
化学答题卷
第Ⅱ卷(非选择题 共31分)
请将选择题的答案填在下表中.
1. [ A ] [ B ] [ C ] [ D ] 2. [ A ] [ B ] [ C ] [ D ]
3. [ A ] [ B ] [ C ] [ D ] 4. [ A ] [ B ] [ C ] [ D ]
5. [ A ] [ B ] [ C ] [ D ] 6. [ A ] [ B ] [ C ] [ D ]
7. [ A ] [ B ] [ C ] [ D ] 8. [ A ] [ B ] [ C ] [ D ]
9. [ A ] [ B ] [ C ] [ D ] 10.[ A ] [ B ] [ C ] [ D ]
11.[ A ] [ B ] [ C ] [ D ] 12.[ A ] [ B ] [ C ] [ D ]
13.[ A ] [ B ] [ C ] [ D ] 14.[ A ] [ B ] [ C ] [ D ]
15.[ A ] [ B ] [ C ] [ D ] 16.[ A ] [ B ] [ C ] [ D ]
17.[ A ] [ B ] [ C ] [ D ] 18.[ A ] [ B ] [ C ] [ D ]
19.[ A ] [ B ] [ C ] [ D ] 20.[ A ] [ B ] [ C ] [ D ]
21.[ A ] [ B ] [ C ] [ D ] 22.[ A ] [ B ] [ C ] [ D ]
23.[ A ] [ B ] [ C ] [ D ]
三、(本题包括2小题,共10分)
24.(3分)蛋白质是生命的基础,没有蛋白质就没有生命.请回答下列问题:
(1).人体摄入的蛋白质在胃蛋白酶和胰蛋白酶的作用下,水解成 ,被人体吸收后,重新结合成人体所需的蛋白质.人体内蛋白质也在不断分解,最后生成尿素排出体外.
(2).蛋白质在一定条件下能发生变性,从而失去生理活性.万一误服硫酸铜溶液,此时应立即作怎样的处理? .
(3).下面物质可以看成是由4个氨基酸缩合掉3个水分子而形成:
这个“多肽”是_____________肽.
25. (7分) (1).黄铜是生活中常用的金属材料,它是铜和_______的合金. 制造焊锡时,把铅加入锡的重要原因是_____________________________.
(2).青霉素是医学上一种常用的抗生素,在体内经酸性水解后得到青霉氨基酸[其结构简式为:
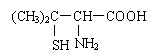
],请写出青霉氨基酸可能具有的一种化学性质 .
(3).阿司匹林是一种传统的治疗感冒发烧的“老”药,从分子结构看,它可以看作是乙酸的酯,其结构简式为 ![]() ,作为一种解热镇痛药,对于感冒发烧,它有较好的疗效,但大剂量长期空腹服用,
,作为一种解热镇痛药,对于感冒发烧,它有较好的疗效,但大剂量长期空腹服用,
容易对胃肠道产生刺激,原因是阿司匹林在胃中会发生酯的水解反应,生成 _____ 和
(用结构简式表示),因此增大了对胃、肠道的刺激.
(4).写出硬脂酸甘油酯皂化反应的化学方程式:____________________________________________.
四、(本题包括2小题,共15分)
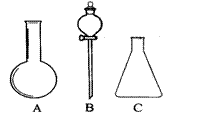 26.(7分)(1).有右图所示A、B、C三种仪器,请选择下列仪器名称的序号,填入相应的空格内:
26.(7分)(1).有右图所示A、B、C三种仪器,请选择下列仪器名称的序号,填入相应的空格内:
①.烧杯 ②.普通漏斗 ③.圆底烧瓶 ④.锥形瓶 ⑤.分液漏斗
A____ B____ C____
(2).为了检验和除去下表中的各种所含杂质(括号里的物质),请从(I)中选出适当的检验试剂,从(Ⅱ)中选出适当的除杂试剂,将所选的答案的括号填人相应的空格内.
| 物 质 | 检验试剂 | 除杂试剂 |
| 甲烷(乙烯) | ||
| 酒 精(水) |
(I)检验的试剂:
A.无水硫酸铜 B.酸性高锰酸钾溶液 C.盐酸 D.氢氧化钠
(Ⅱ)除杂试剂:
a.硫酸 b.乙酸 c.新制的生石灰 d.溴水
27.(8分)现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
|
|
|
![]()
![]()
![]()
![]()
![]()
![]() ②
②
|
水 B C
![]() ①
③
④
①
③
④
|
|
|
![]()
![]()
![]()
![]() ⑥
⑤
⑥
⑤
![]()
![]()
|
请根据以上信息回答下列问题:
(1).写出下列物质的化学式: C
(2).写出下列反应的化学方程式:
反应③
反应⑥
(3).用电子式表示丙的形成过程________________________________________
五、计算题(共6分)
28.(6分) 取100mLNa2CO3和Na2SO4的混合液,加入过量BaCl2溶液后得到14.51g白色沉淀,用过量稀硝酸处理后沉淀质量减少到4.66g,并有气体放出.试计算:
(1).原混合物中Na2CO3和Na2SO4的物质的量浓度. (2).产生的气体在标准状况下的体积.
化 学 参 考 答 案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 | B | B | B | C | D | C | D | B | C | C | D | D |
| 题号 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | |
| 答案 | A | A | B | D | D | B | C | D | B | A | C |
24.(每空1分) (1).氨基酸
(2).喝大量的牛奶(或豆浆或鸡蛋清)或灌肥皂水(任写出一种即可)
(3).四肽
25.(除方程式2分,其余每空各1分)(1).锌,降低熔点
(2).酸性、碱性、与金属钠反应、能发生酯化反应等(任写出一种即可)
(3).略.
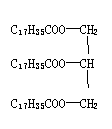
|
+3NaOH![]() 3 C17H35COONa +
3 C17H35COONa +
26.(1). ③⑤④ (2).B d;A c (每空1分)
27. (每空2分)(1).Fe
(2). 2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑
FeCl3 + 3NaOH = Fe(OH)3 ↓+ 3NaCl
(3).略.
28. (1).C(Na2CO3) = 0.5mol/L C(Na2SO4) = 0.2mol/L (2).1.12L (各2分)