六、原电池、电解池综合练习
【例题精选】:
|
|
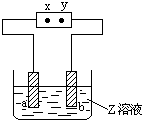
例1:右图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的是
| a极板 | b极板 | x电极 | Z溶液 | |
| A | 锌 | 石墨 | 负极 | CuSO4 |
| B | 石墨 | 石墨 | 负极 | NaOH |
| C | 银 | 铁 | 正极 | AgNO3 |
| D | 铜 | 石墨 | 负极 | CuCl2 |
解析:通电后a极板增重,表明溶液中金属阳离子在a极板上放电,发生还原反应析出了金属单质,因此可确定a极板是电解池的阴极,与它相连接的直流电源的x极是负极。选项C中x极为正极,故C不正确。A中电解液为CuSO4溶液,阴极a板上析出Cu而增重,阳极b 板上由于OH-离子放电而放出无色无臭的O2,故A正确。B中电解液为NaOH溶液,通电后阴极a上应放出H2,a极板不会增重,故B不正确。D中电解液为CuCl2溶液,阴极a板上因析出Cu而增重,但阳板b板上因Cl-离子放电,放出黄绿色有刺激性气味的Cl2,故D不正确。
答案:A。
例2:蓄电池在放电时起原电池的作用,在充电时起电解池的作用。下面是爱迪生蓄电池分别在充电和放电时发生的反应:
![]()
下列有关爱迪生蓄电池的推断错误的是:
A.放电时,Fe是负极,NiO2是正极
B.蓄电池的电极可以浸入某中酸性电解质溶液中
C.充电时,阴极上的电极反应为:![]()
D.放电时,电解质溶液中的阴离子向正极方向移动
解析:蓄电池放电时起原电池作用,原电池的负极是较活泼的金属,A正确。放电时,Fe是原电池的负极,Fe失电子被氧化成Fe2+离子。由于负极——Fe的附近聚集较多的Fe2+离子,电解质溶液中的阴离子向负极移动,D不正确。充电时蓄电池起电解池作用,充电时电源的负极应与蓄电池的负极(Fe,此时作为电解池的阴极)相连接,发生还原反应:![]() 。C正确。该蓄电池的放电和充电时的电极反应分别是:
。C正确。该蓄电池的放电和充电时的电极反应分别是:
放电:负极 ![]()
正极 ![]()
充电:阴极 ![]()
阳极 ![]()
可见反应是在碱性溶液中进行的,B不正确。
答案:B、D。
|
|
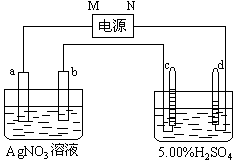
例3:右图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336mL(标准状态)气体。回答:
(1)直流电源中,M为 极。
(2)Pt电极上生成的物质是 ,其质量为 g。
(3)电源输出的电子,其物质的量与电极b、c、d分别生成的物质的物质的量之比为:2∶ ∶ ∶ 。
(4)AgNO3溶液的浓度(填增大、减小或不变。下同) ,AgNO3溶液的pH ,H2SO4溶液的浓度 ,H2SO4溶液的pH 。
(5)若H2SO4溶液的质量分数由5.00%变为5.02%,则原有5.00%的H2SO4溶液为 g。
解析:电解5.00%的稀H2SO4,实际上是电解其中的水。因此在该电解池的阴极产生H2,阳极产生O2,且![]() 。据此可确定d极为阴极,则电源的N极为负极,M极为正极。在336mL气体中,
。据此可确定d极为阴极,则电源的N极为负极,M极为正极。在336mL气体中,![]() ,为0.01mol,
,为0.01mol,![]() ,为0.005mol。说明电路上有0.02mol电子,因此在b极(Pt、阴极)产生
,为0.005mol。说明电路上有0.02mol电子,因此在b极(Pt、阴极)产生![]() ,即 0.02mol的Ag。则n(e) ∶n(Ag) ∶n(O2) ∶n(H2)=
,即 0.02mol的Ag。则n(e) ∶n(Ag) ∶n(O2) ∶n(H2)=
0.02∶0.02∶0.005∶0.01=2∶2∶![]() ∶1.
∶1.
由Ag(阳)电极、Pt(阴)电极和AgNO3溶液组成的电镀池,在通电一定时间后,在Pt电极上放电所消耗溶液中Ag+离子的物质的量,等于Ag电极被还原给溶液补充的Ag+离子的物质的量,因此[AgNO3]不变,溶液的pH也不变。电解5.00%的H2SO4溶液,由于其中的水发生电解,因此[H2SO4]增大,由于[H+]增大,故溶液的pH减小。
设原5.00%的H2SO4溶液为xg,电解时消耗水0.01×18 = 0.18g,则:![]() ,解得:
,解得:![]() 。
。
答案:(1)正;(2)Ag、2.16;(3)2∶![]() ∶1;(4)不变、不变、增大、减小;(5)45.18。
∶1;(4)不变、不变、增大、减小;(5)45.18。
|
|
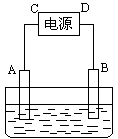
例4:有一硝酸盐晶体,其化学式表示为M(NO3)x·nH2O经测定其摩尔质量为242g·mol-1。取1.21g该晶体溶于水配成100mL溶液。将此溶液倒入右图所示装置中,用石墨作电极进行电解。当有0.01mol电子通过电极时,溶液中的金属阳离子全部析出,在A极得到金属0.32g。回答:
(1)金属M的原子量为 ,x = ,
n = 。
(2)C极为 极。
(3)电解后溶液的pH为(设电解前后溶液的体积不变) 。
解析:(1)![]() ,含金属M也为
,含金属M也为![]() 。M的原子量
。M的原子量![]() 。
。![]()
![]() 解得:
解得:![]()
188 + 18 n =242,n = 3。
(2) 因为金属在A极析出,所以A极是电解池的阴极,则C极是电源的负极。
(3)有0.01mol电子通过电极,就有0.01mol OH-放电,在溶液中就生成0.01mol H+。![]()
答案:(1)64、2、3;(2)负;(3)1。
【综合练习】:
一、选择题:
1、下列说法中正确的是:
A.在磷酸钠溶液中![]()
B.pH=10的NaOH 溶液加水稀释100倍,溶液的pH=12
C.0.3![]() 的CH3COOH溶液中的[H+]是0.1
的CH3COOH溶液中的[H+]是0.1![]() CH3COOH溶液中[H+]
CH3COOH溶液中[H+]
的3倍
D.100℃时,纯水的pH=6,它显中性
2、25 mL pH=10的KOH溶液跟50 mL pH=10的Ba(OH)2溶液混合,混合溶液的pH是:
A.9.7 B.10 C.10.3 D.10.7
3、在1 L浓度为C![]() 的弱酸HA溶液中,HA、H+和A--的物质的量之和为nC mol,则HA的电离度是。
的弱酸HA溶液中,HA、H+和A--的物质的量之和为nC mol,则HA的电离度是。
A.![]() B.
B.![]()
C.![]() D.
D.![]()
4、相同温度、相同物质的量浓度的下列各溶液:①Na2SO3、②Na2SO4、③NaHSO4、④NH4HSO4,按pH由小到大的顺序排列,应是:
A.④<③<②<① B.②<①<③<④
C.②<③<④<① D.①<②<③<④
5、相同物质的量浓度的三种盐溶液:NaX、NaY、NaZ,其溶液的pH依次增大,则它们对应的三种酸的强弱顺序是:
A.HX<HY<HZ B.HX<HZ<HY
C.HX<HY<HZ D.HX<HZ<HY
6、一种一元强酸HA溶液中加入一种碱MOH反应后,溶液呈中性,下列判断正确的是:
A.加入的碱过量 B.混合前酸与碱中溶质的物质的量相等
C.生成的盐不发生水解 D.反应后溶液中A-、M+物质的量浓度相等
7、下列四种溶液中,由水电离生成的氢离子物质的量浓度之比(①∶②∶③∶④)是:
①pH = 0的盐酸 ②0.1![]() 的盐酸 ③0.01
的盐酸 ③0.01![]() 的NaOH溶液
的NaOH溶液
④pH = 11的NaOH溶液
A.1∶10∶100∶1000 B.0∶1∶12∶11
C.14∶13∶12∶11 D.14∶13∶2∶3
8、将体积都为10mL、pH都等于3的醋酸和盐酸,加水稀释至a mol和b mol,测得稀释后溶液的pH均为5。则稀释后溶液的体积:
A.![]() B.
B.![]()
C.a < b D.a > b
9、在盛有饱和Na2CO3溶液的烧杯中插入惰性电极,保持温度不变,通直流电一段时间后,则:
A.溶液的pH增大 B.溶液的浓度增大,有一定量的晶体析出
C.溶液的浓度不变,有晶体析出 D.溶液的pH减小
10、氢镍电池是近年开发出来的可充电电池,它可以取代会产生镉污染的镉镍电池。氢镍电池的总反应式是![]()
![]()
![]() 。 根据此反应式判断,下列叙述中正确的是:
。 根据此反应式判断,下列叙述中正确的是:
A.电池放电时,电池负极周围溶液的pH值不断增大
B.电池放电时,镍元素被氧化
C.电池充电时,氢元素被还原
D.电池放电时,H2是负极
11、用惰性电极电解M(NO3)x的水溶液,当阴极上增重a g时,在阳极上同时产生b L氧气(标准状况),从而可知M的原子量为:
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
12、下列关于铜电极的叙述正确的是:
A.铜锌原电池中铜是正极
B.用电解法精炼粗铜时粗铜作阴极
C.在镀件上电镀铜时可用金属铜作阳极
D.电解稀硫酸制H2、O2时铜作阳极
13、在室温下等体积的酸和碱的溶液,混合后pH一定小于7的是:
A.pH = 3的硝酸跟pH = 11的氢氧化钾溶液
B.pH = 3的盐酸跟pH = 11的氨水
C.pH = 3的硫酸跟pH = 11的氢氧化钠溶液
D.pH =3的醋酸跟pH = 11的氢氧化钡溶液
14、实验室用铅蓄电池作电源电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应:
负极:![]() ;
;
正极:![]()
今若制得Cl2 0.050mol,这时电池内消耗的H2SO4的物质的量至少是:
A.0.025 mol B.0.050 mol C.0.10 mol D.0.20mol
15、在水电离出的![]()
![]() 的溶液中,能大量共存的离子组是:
的溶液中,能大量共存的离子组是:
A.![]() B.
B.![]()
C.![]() D.
D.![]()
16、将0.1![]() 的盐酸100 mol和0.1
的盐酸100 mol和0.1![]() 的偏铝酸钠溶液50 mL混合,在所得溶液中:
的偏铝酸钠溶液50 mL混合,在所得溶液中:
A.![]()
B.![]()
C.![]()
D.![]()
17、硫化氢水溶液中有如下动态平衡关系:H2S![]() H++HS-,HS-
H++HS-,HS-![]() H+
+ S2-,H2O
H+
+ S2-,H2O![]() H+
+ OH-。在稀氢硫酸溶液中,下列各关系正确的是:
H+
+ OH-。在稀氢硫酸溶液中,下列各关系正确的是:
A.![]()
B.![]()
C.![]()
D.![]()
18、已知0.1![]() NaHCO3溶液的pH = 8.4,0.1
NaHCO3溶液的pH = 8.4,0.1![]() Na2CO3溶液的
Na2CO3溶液的
pH = 11.4,则NaHCO3溶液中的[OH-]是Na2CO3溶液中的[OH-]的:
A.3倍 B.![]() 倍 C.103倍 D.10-3倍
倍 C.103倍 D.10-3倍
19、用0.1![]() NaOH溶液滴定100mL 0.1
NaOH溶液滴定100mL 0.1![]() 盐酸时,如果滴定误差在
盐酸时,如果滴定误差在![]() (指滴入NaOH溶液的体积)以内,则所得溶液的pH范围为(已知a分别为2、3、4、5时,lg a分别为0.30、0.48、0.60、0.70):
(指滴入NaOH溶液的体积)以内,则所得溶液的pH范围为(已知a分别为2、3、4、5时,lg a分别为0.30、0.48、0.60、0.70):
A.6.7—7.1 B.3.3—10.7 C.4.3—9.7 D.6—8
20、用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,下列实验操作会引起测定结果偏高的是:
①用天平称量NaOH固体时,将NaOH放在右盘,砝码放在左盘,并移动游码使之平衡。②配制NaOH溶液时,将称量的NaOH固体溶于水后立即移入容量瓶,并加蒸馏水至刻度线。③用蒸馏水洗净锥形瓶后盛入待测NaOH溶液进行滴定。④用蒸馏水洗净酸滴定管后盛入标准盐酸进行滴定。⑤滴定终点读取酸滴定管数据时,仰视刻度线。
A.①⑤ B.②④⑤ C.②③④⑤ D.①②③④⑤
二、填空题:
1、现有A、B、C、D四种金属,若将A和B用导线相连,浸入稀硫酸中,A上有气泡产生;若将D放入B的硝酸盐溶液中,D表面有B析出;若在含有A和C两种离子的盐溶液中进行电解,阴极上有C析出。试判断,这四种金属还原性递减的顺序是 ,若四种金属之一是铜,铜可能是 ,不可能是 。
|
|
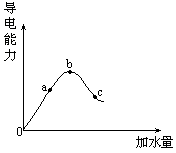
2、在一定温度下,冰醋酸加水稀释的过程中,溶液的导电能力如右图所示。回答:(1)“0”点导电能力为0的理由 ,(2) a、b、c三点溶液的pH由小到大的顺序是 ,(3)a、b、c三点中电离度最大的是 ,(4)若使c点溶液中[CH3COO-]增大,溶液的pH也增大,可加入的物质有:① 、② 、③ 。
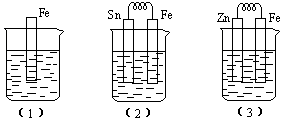
3、如下图所示,烧杯中都盛有稀硫酸。(1)中反应的离子方程式为 ,(2)中的电极反应:Fe: 、Sn: 、Sn极附近溶液的pH(填增大、减小或不变) ,(3)中被腐蚀的金属是 、其电极反应式为 。比较(1)、(2)、(3)中纯铁被腐蚀的速率由快到慢的顺序是 。
三、计算题:
1、某温度下将一定量密度为1.15g/cm3的NaCl溶液用石墨电极通直流电,设NaCl恰好完全反应,且无其它反应发生,得到的溶液中氧元素的质量百分含量为80%。(1)求电解后溶液中溶质与溶剂的物质的量之比,(2)求原NaCl溶液的物质的量浓度。
2、稀硫酸和稀盐酸的混合液50mL,加入Ba(OH)2粉末2.137g,充分反应过滤得干燥沉淀物 1.165g,母液的pH为13,求原混合溶液中![]() 和Cl-的物质的量浓度分别为多少?
和Cl-的物质的量浓度分别为多少?
【答案】:
一、
1、D 2、B 3、C 4、A 5、C
6、D 7、A 8、D 9、C 10、CD
11、C 12、AC 13、D 14、C 15、B
16、C 17、A 18、D 19、C 20、B
二、
1、D>B>A>C,A或C,B或D。
2、(1)冰醋酸未发生电离反应,无自由移动的离子。
(2)b < a < c。
(3)C
(4)①加NaOH 固体、②加CH3·COONa固体、③加活泼金属。
3、(1)![]()
(2)![]() 、增大。
、增大。
(3)Zn、![]() 。
。
三、1、(1)1 ∶10,(2)4.48![]() 。
。
2、0.1![]() 、0.2
、0.2![]() 。
。
部分习题解析:
一、
7、①![]()
![]() ,
,![]()
![]() ;
;
②![]()
![]() ,
, ![]()
![]()
③![]()
![]() ,
,![]()
![]()
④![]()
![]() ,
,![]()
![]()
①∶②∶③∶④![]() 。
。
10、放电时该装置作为原电池,氢元素由0价升高为+1价,H2是负极,H原子失电子变成H+离子,负极周围溶液的pH不断减小。镍元素由+3价降低为+2价,镍元素被还原。因此A、B不正确,D正确。充电时该装置作为电解池,氢元素由+1价降低为0价,氢元素被还原。C正确。
11、电解时阴极增重,说明有金属析出,则电解方程式为:
![]()
![]()
![]() 。设金属M的摩尔质量为M,则:
。设金属M的摩尔质量为M,则:
M——![]()
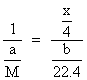 解得:
解得:![]()
14、铅蓄电池的总反应式为:Pb + PbO + 2H2SO4![]() 2PbSO4+2H2O。电解NaCl饱和溶液时,电路上有2 mol电子通过时消耗2 mol的H2SO4,此时在阳极应产生1 mol Cl2。若要制得0.050mol Cl2,需消耗H2SO4为0.10 mol。
2PbSO4+2H2O。电解NaCl饱和溶液时,电路上有2 mol电子通过时消耗2 mol的H2SO4,此时在阳极应产生1 mol Cl2。若要制得0.050mol Cl2,需消耗H2SO4为0.10 mol。
18、NaHCO3:pH = 8.4,[H+]1=10-8.4,[OH-]1=10-5.6;Na2CO3:pH = 11.4,
[H+]2=10 -11.4,[OH-]2=10-2.6,![]() 。
。
19、如果误差为0.1%,即多滴了0.1mL NaOH,混合液中
![]() ,
,![]() ,pH = 9.7;
,pH = 9.7;
如果误差为-0.1%,即少滴入了0.1mL NaOH,混合液中
![]() , pH = 4.3。
, pH = 4.3。
三、
1、设电解后溶液中含NaOH x mol、H2O y mol,则![]() 。解得:x∶y = 1∶10。电解方程式为:2NaCl + 2H2O
。解得:x∶y = 1∶10。电解方程式为:2NaCl + 2H2O![]() 2NaOH + H2
2NaOH + H2![]() +Cl2
+Cl2![]() ,可知电解前原溶液中含NaCl x mol,含H2O(x + y)mol。当x = 1、y = 10时,
,可知电解前原溶液中含NaCl x mol,含H2O(x + y)mol。当x = 1、y = 10时,
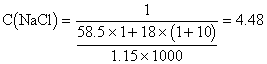
![]() 。
。
2、已知![]() ,故可知混合液中
,故可知混合液中![]() 。则
。则![]()
![]() 。加入的Ba(OH)2中和掉混合液中的H2SO4后仍余
。加入的Ba(OH)2中和掉混合液中的H2SO4后仍余![]() ,又母液pH = 13,可知Ba(OH)2中和掉混合液中的HCl仍有剩余,余Ba(OH)2为0.0025 mol,故与HCl中和的Ba(OH)2为0.0075-0.0025 =
0.005mol,则HCl为0.01mol,
,又母液pH = 13,可知Ba(OH)2中和掉混合液中的HCl仍有剩余,余Ba(OH)2为0.0025 mol,故与HCl中和的Ba(OH)2为0.0075-0.0025 =
0.005mol,则HCl为0.01mol,![]()
![]() 。
。