(碳族、非金属材料)单元检测题
命题人:lg 学号________. 姓名________.
第Ⅰ卷(选择题)
一.选择题 (请将你认为正确的答案代号填在Ⅱ卷的答题栏中,本题共10小题)
1. 将SO2气体通人BaCl2溶液至饱和,未见有沉淀生成,继续通入另一种气体仍无沉淀产
生。则通入的气体可能是
A.CO2 B.NH3 C.NO2 D.C12
2. 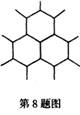 石墨是层状晶体,每一层内,碳原子排列成正六边形,许多个正六边形排列成平面网状结构。如果每两个相邻碳原子间可以形成一个碳碳单键,则石墨晶体中每一层碳原子数与碳碳单键数的比是
石墨是层状晶体,每一层内,碳原子排列成正六边形,许多个正六边形排列成平面网状结构。如果每两个相邻碳原子间可以形成一个碳碳单键,则石墨晶体中每一层碳原子数与碳碳单键数的比是
A.1:1 B.1:2 C.1:3 D.2:3
3. 超临界液体是物质介于气态和液态之间的一种新的状态。目前应用最广的是超临界二氧
化碳,在化学工业中可取代氟利昂等溶剂、发泡剂。下列有关超临界二氧化碳的说法中错
误的是
A.超临界二氧化碳是新合成的一种物质
B.超临界二氧化碳由C02分子组成
C.用超临界二氧化碳溶解物质后,可在常温常压使二氧化碳挥发将其除去
D.用超临界二氧化碳代替氟利昂可减轻对臭氧层的破坏
4. 在容积为672 mL的烧瓶里充满NO、NO2的混合气体,将其倒立在水槽里,去塞后再通人280 mL氧气,恰好完全反应,且水充满烧瓶(气体体积都折合成标准状况下)。下列有关叙述中,正确的是
A.总反应为NO+ NO2+O2+H2O=2HNO3
B.总反应为4NO+8 NO2+5O2+6H2O=12HNO3
C.生成HNO3的物质的量浓度接近O.03 mol·L-1
D.生成HNO3的物质的量浓度约为0.045 mol·L-1
5. 将过量的CO2分别通入①CaCl2溶液 ②Na2Si03溶液 ③Ca(CIO)2溶液 ④饱和
Na2CO3溶液。最终溶液中有白色沉淀析出的是
A.①②③④ B.②④ C.①②③ D.②③④
6. 下列说法正确的是:
A.酸性氧化物在常温下均为气态 B.酸性氧化物一定能与碱反应生成盐和水
C.酸性氧化物有可能是金属氧化物 D.非金属氧化物都是酸性氧化物
7. 下列单质中,最难与H2化合的是
A.C12 B.C C.N2 D.O2
8. 下列关于材料用途的说法中不正确的是:
A.氧化铝陶瓷可用做高压钠灯的灯管 B.氮化硅陶瓷可用做陶瓷发动机的材料
C.光导纤维可用做遥测遥控,照明等 D.氧化铝陶瓷可用做半导体材料
9. 下列关于非金属元素的叙述中正确的是
A.非金属元素的原子最外层电子数都大予或等于4
B.非金属元素的原子都易得电子生成相应的阴离子
C只由非金属元素组成的晶体一定属于分子晶体
D.每一个主族包含的元素中不一定都有非金属元素
10. 将CO2通入下列物质的溶液中不与其反应的是
①Na2CO3 ②Na2SiO3 ③NaAlO2 ④C6H5ONa⑤Ca(ClO)2 ⑥CaCl2 ⑦CaCO3
A.①③④⑤⑥ B.①和⑥ C.只有① D.只有⑥
第Ⅱ卷(非选择题 共3道简答题1道实验题2道计算题
请将你认为正确的答案代号填在下表中
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
二.简答题 (共3小题)
11. BGO是我国研制的一种闪烁晶体材料,它是锗酸铋的简称,曾用于诺贝尔奖获得者丁肇中的著名实验中。若知:①在BGO中,锗处于其最高价态;②在BGO中,铋的价态与铋跟氯气形成某种氯化物时所呈的价态相同,在此氯化物中铋具有最外层8电子有稳定结构;③BGO可看成是由锗和铋两种元素的氧化物所形成的复杂氧化物,且在BGO晶体的化学式中,这两种氧化物所含的氧的总质量相同。请填空:
1.锗和铋的元素符号分别是____________和____________。
2.BGO晶体的化学式是____________
3.BGO晶体中所含铋氧化物的化学式是____________。
12. 若把Fe3O4看作“混合氧化物”时可以写成FeO·Fe2O3,若看作一种盐时又可写成Fe(FeO2)2。根据化合价规律和这种书写方法,Pb3O4可以分别写成____________和____________。等物质的量的Fe3O4和Pb3O4分别和浓盐酸反应时,所消耗HCl的物质的量相等,不同的是高价的铅能将盐酸氧化而放出氯气。试写出Fe3O4.Pb3O4分别和浓盐酸反应的化学方程式:____________________________; ____________________________
13. 环保检测中,有害气体的浓度常用1L气体样品中含有害气体的毫克值(mg/L)来表示,如对某气体样品中所含CO的浓度进行测定,其方法和步骤如下:
①首先将2.00L的气体样品通过盛有I2O5固体的加热管,反应后生成CO2和I2;
②用30.0mL5.00×10-3mol/L的硫代硫酸钠溶液吸收所产生的碘,发生的反应为:
I2+2S2032- =2I-+S4O62-;
③将②中溶液取出1/5,加入1.00mLl.00×10-2mol/L碘水,正好将所取溶液中过量的硫代硫酸钠完全氧化。
(1)写出步骤①中CO通过盛I2O5加热管的有关反应的化学方程式。__________________
(2)计算样品中CO的浓度。____________________________________
三.实验题 (共1小题)
14. 一般测定样品中成分含量的实验应重复二至三次。为了测定某氢氧化钠固体中混有的碳酸钠的质量分数,甲、乙两位同学分别设计了如下实验方案:
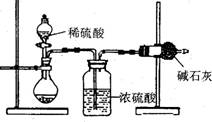 I.甲同学的方案如右图所示:
I.甲同学的方案如右图所示:
(1)根据甲同学的实验装置图分析,在每次实验过
程中所进行的称量操作至少要进行
次。
(2)甲同学重复测定了三次,得到碳酸钠的质量分
数的数据存在较大的偏差,你认为原因可能是
(填序号)。
A.装置内原有空气中的二氧化碳气体也被碱石灰吸收
B.装置外空气中的水蒸气和二氧化碳被碱石灰吸收
C.反应完成后,装置中的二氧化碳没有全部被碱石灰吸收
D.加入稀硫酸的量不足,则可能造成误差
II.乙同学的方案是:称取样品m g,并溶解,加过量氯化钡溶液,过滤、洗涤、烘干,称量得固体n g。
(1)混合物中碳酸钠的质量分数为(用m、n表示) 。
(2)洗涤沉淀的操作要点是 。
(3)Ca2+、Ba2+都可以使![]() 沉淀完全,但乙同学使用氯化钡溶液而不用氯化钙溶液的原因是
;测定
沉淀完全,但乙同学使用氯化钡溶液而不用氯化钙溶液的原因是
;测定![]() 的量,若使用氢氧化钡溶液而不用氢氧化钙溶液,结果将具有更高的精确度,原因是
。
的量,若使用氢氧化钡溶液而不用氢氧化钙溶液,结果将具有更高的精确度,原因是
。
四.计算题 (共2小题)
15. 在5.6gCaCO3和MgCO3组成的混合物中加入足量的盐酸,产生的气体全部被500mL,0.2mol/L的NaOH溶液吸收,把吸收后所得的溶液在减压.低温的条件下蒸干,可得5.92g固体(假设固体中不含结晶水),求原混合物中两物质的质量。
16. 将粉末状的NaHCO3 和Na2CO3 的混合物若干克加热至完全反应,使生成的气体通入足量的饱和石灰水中,完全反应后生成白色沉淀20 g,向加热后的残留物中加入足量盐酸生成气体6.72 L(标准状况)。
(1)完成上述各步发生反应的化学方程式;
(2)求原混合物中NaHCO3 和Na2CO3 的物质的量各是多少?
(碳族、非金属材料)单元检测题
参考答案(仅供参考)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| A | D | A | B | B | C | B | D | D | D |
二.简答题答案:
11. (1)Ge Bi (2) Bi4Ge3O12 (3) Bi2O3
12. 2PbO·PbO2和Pb2PbO4;Fe3O4 +8HCl=FeCl2 +2FeCl3 +4H2O; Pb3O4 +8HCl ==3PbCl2 +Cl2↑ +4H2O
13. (1)5CO+I2O5═I2+5CO2
(2)根据5CO+I2O5═I2+5CO2和I2+2S2O2-3═2I-+S4O62-
CO的浓度:1.75mg/L
三.实验题答案:
14. (1).106n/197m (2)验玻璃棒向过滤器中的沉淀加水至淹没,静置使滤出,重复2~3次 (3)氢氧化钙微溶;碳酸钡分子量大,相对误差小
四.计算题答案:
15. ![]()
![]()
16. (1)略 (2)0.4mol 0.1mol