高二化学“必修本”专用
第二章 《电离平衡》 检测题
(测验时间40分钟)
班次 学号 姓名 成绩
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | *13 | *14 |
| 选项 |
一、选择题(每题有1~2个选项符合题意,每小题4分,共48分+10分。)
1.下列说法正确的是
A.强电解质一定是离子化合物
B.强电解质、弱电解质的电离都是吸热过程
C.强电解质的饱和溶液一定是浓溶液
D.强电解质在水中一定能全部溶解
2.物质的量浓度都为0.1 mol/L的下列溶液中,pH最小的是
A.NH4Cl B.NaCl
C.CH3COONa D.NaNO3
3.在CH3COOH溶液中存在如下平衡:CH3COOH ![]() H++CH3COO-,加入少量下列物质能使平衡向左移动的是
H++CH3COO-,加入少量下列物质能使平衡向左移动的是
A.NaCl B.CH3COONa
C.Na2CO3 D.NaOH
4.下列物质在水溶液中存在着电离平衡的是
A.HF B.NHO3
C.C2H5OH(酒精) D.Na2SO4
5.某固定化合物A不导电,但熔化或溶于水都能完全电离。下列关于物质A的说法中,正确的是
A.A为非电解质 B.A是弱电解质
C.A是离子化合物 D.A为易溶性盐
6.将①H+、②Cl-、③Al3+、④K+、⑤S2-、⑥OH-、⑦NO3-、⑧NH4+分别加入H2O中,基本上不影响水的电离平衡的是
A.①③⑤⑦⑧ B.②④⑦
C.①⑥ D.②④⑥⑧
7.下列有关中和滴定的操作:①用标准液润洗滴定管;②往滴定管内注入标准溶液;③检查滴定管是否漏水;④滴定;⑤滴加指示剂于待测液;⑥洗涤。正确的操作顺序是
A.⑥③①②⑤④ B.⑤①②⑥④③
C.⑤④③②①⑥ D.③①②④⑤⑥
8.100 mL 6mol/L H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的
A.碳酸钠(s) B.醋酸钠(s)
C.硫酸钠(aq) D.硫酸钾(s)
9.若溶液中由水电离产生的[OH-]=1×10-14 mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是
A.Al3+ Na+ NO3- Cl- B.K+ Na+ Cl- NO3-
C.K+ Na+ Cl- AlO2- D.K+ NH4+ SO42- NO3-
10.pH值相等的盐酸(甲)和醋酸(乙),分别与锌反应,若最后锌已全部溶解且放出气体一样多,为此下列说法正确的是
A.反应开始时的速率:甲=乙
B.反应所需时间:甲<乙
C.反应开始时,酸的物质的量浓度:甲<乙
D.反应结速时,pH值:甲<乙
11.在某温度下,将某NaOH溶液和0.1 mol ·L-1的HAc溶液充分混合后,若溶液呈中性,则该混合溶液中有关离子的浓度应满足的关系是
A.[Na+]=[Ac-] B.[Na+]>[Ac-]
C.[Na+]<[Ac-] D.[Na+]+[H+]=[OH-]+[Ac-]
12.常温下,把pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,在所得溶液中离子浓度大小关系正确的是
A.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.c(Na+)+c(H+)>c(CH3COO-)+c(OH-)
C.c(CH3COO-)>c(Na+)>c(H+)=c(OH-)
D.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
*13.将0.1 mol·L-1CH3COOH溶液加水稀释或加入少量CH3COONa晶体时,都会引起
A.溶液的pH增加 B.CH3COOH电离度变大
C.溶液的导电能力减弱 D.溶液中[OH-]减小
*14.在相同温度下等体积、等物质的量浓度的4种稀溶液:①Na2SO4 ②H2SO3 ③NaHSO3
④Na2S,所含带电微粒的数目由多到少的顺序是
A.①=④>③=② B.①=④>③>②
C.①>④>③>② D.④>①>③>②
二、填空题
15.(16分)根据NH2·H2O的电离方程式 。结合变化量填下表。
|
 | H2O | NH4Cl (s) | NaOH (s) | HCl (1) | ||||||||||||||||||
| (1)Kb | ||||||||||||||||||||||
| (2)n (OH-) | ||||||||||||||||||||||
| (3)c (OH-) | ||||||||||||||||||||||
| (4)平衡移动方向 |
16.(10分)当滴有少量CH3COOH的CH3COONH4的混合物溶于水后,存在着的电离或离子反应的平衡有:
(1) ,(2) 。
(3) 。
由于 平衡的存在,抑制了 平衡的移动。
17.(6分)某可溶性盐的化学式XmYn(m≠n),将一定量的该盐溶于适量的水中。
(1)若测得溶液的pH为3,则该盐与水反应的离子方程式可能为
。
(2)若该盐水溶液的pH为11,则其与水反应的离子方程式可能为
。
 三、实验题(10分)
三、实验题(10分)
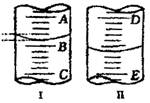
18.如图
(1)图I表示10mL量筒中液面的位置,A与B、B与C刻度相差1mL,如果刻度A为4,量筒中液体体积是 mL。
(2)图II表示50mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号) 。
A.是a mL B.是(50-a)mL
C.一定大于a mL D.一定大于(50-a)mL
四、计算题(10分+10分)
19.量取25.00mL未知浓度的硝酸溶液,用去10.50mL浓度为0.120mol·L-1NaOH溶液进行滴定,又再用去14.50mL浓度为0.120mol·L-1的KOH继续滴定恰好安全反应,求该HNO3溶液的浓度是多少?
*20.某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:H2A ![]() H++HA-,
H++HA-,
HA-
![]() H++A2-,已知K1>K2,设有下列四种溶液:
H++A2-,已知K1>K2,设有下列四种溶液:
A.0.01 mol·L-1的H2A溶液
B.0.01 mol·L-1的NaHA溶液
C.0.02 mol·L-1的HCl溶液与0.04 mol·L-1的NaHA溶液等体积混合
D.0.02 mol·L-1的NaOH溶液与0.02 mol·L-1的NaHA溶液等体积混合
据此填写下列空白(填代号):
(1)c(H+)最大的是 ,最小的是 。
(2)c(H2A)最大的是 ,最小的是 。
(3)c(A2-)最大的是 ,最小的是 。
第二章 电离平衡 检测题
参考答案
一、选择题(共48分+10分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | *13 | *14 |
| 选项 | B | A | BD | A | C | B | A | BC | B | AC | AD | A | A | D |
二、填空题(共32分)
15.(16分)NH3·H2O ![]() NH4++OH-;
NH4++OH-;
(1)不变,不变,不变,不变;
(2)增加,减少,增加,减少;
(3)减少,减少,增加,减少;
(4)正向,逆向,逆向,正向。
16.(10分)(1)CH3COOH ![]() CH3COO-+H+,
CH3COO-+H+,
(2)NH4++H2O![]() NH3·H2O+H+
NH3·H2O+H+
(3)CH3COO-+H2O![]() CH3COOH+OH- (1), (3)
CH3COOH+OH- (1), (3)
17.(3分)(1)Xn++nH2O![]() X(OH)n+nH+
X(OH)n+nH+
(3分)(2)Ym-+H2O ![]() HY(m-1)-+OH-
HY(m-1)-+OH-
三、实验题(10分)
18.(1)3.2 (2)D
四、计算题(共10+10分)
19.(10分)
解:C(HCl)=![]() =0.120mol·L-1
=0.120mol·L-1
*20.(10分)
(1)A,D (2)C,D (3)D,A