![]()
|
|
学科:化学 |
| 教学内容:第二章 化学平衡单元达纲检测 |
【同步达纲练习】
一、选择题
1.对于mA(g)+nB(g) ![]() pC(g)+qD(g)反应,在压强为p时,化学反应速率用vA、vB、vC、vD表示,当迅速升压到p′时,化学反应速率用v′A、v′B、v′C、v′D表示,下列式子:①
pC(g)+qD(g)反应,在压强为p时,化学反应速率用vA、vB、vC、vD表示,当迅速升压到p′时,化学反应速率用v′A、v′B、v′C、v′D表示,下列式子:①![]() =
=![]() ②mvA=pvC
③
②mvA=pvC
③![]() =
=![]() ④
④![]() =
=![]() ⑤
⑤![]() =
=![]() ⑥
⑥![]() <
<![]() 其中正确的组合是 ( )
其中正确的组合是 ( )
A.①④⑥ B.②④⑥ C.②③⑤ D.①③⑤
2.反应aA(g)+bB(g) ![]() cC(g) 有如下性质: v正=K1〔c(A)〕a·〔c(B)〕b,v逆=K2·〔c(C)〕c,K1、K2在温度一定时为常数,在其他条件不变时,当压强增大一倍则v正应为原来的( )
cC(g) 有如下性质: v正=K1〔c(A)〕a·〔c(B)〕b,v逆=K2·〔c(C)〕c,K1、K2在温度一定时为常数,在其他条件不变时,当压强增大一倍则v正应为原来的( )
A.a倍 B.b倍 C.2a倍 D.2a+b倍
3.在一定温度下,可逆反应4A(g)+5B(g) ![]() 4C(g)+6D(g)达到平衡的标志是( )
4C(g)+6D(g)达到平衡的标志是( )
A.单位时间内消耗nmol的A,同时生成nmol的C
B.单位时间内消耗4nmol的A,同时消耗5nmol的B
C.A、B、C、D的分子数之比为4∶5∶4∶6
D.容器内的总压不随时间变化
4.在密闭容器中进行如下反应:N2+3H2![]() 2NH3,若将平衡系中各物质的浓度都增大到原来的2倍,则产生的结果是( )
2NH3,若将平衡系中各物质的浓度都增大到原来的2倍,则产生的结果是( )
A.平衡不移动 B.平衡向正反应方向移动
C.平衡向逆反应方向移动 D.正反应速率增大,逆反应速率减小
5.在一个固定容积的密闭容器中,可逆反应:mA(g)+nB(g) ![]() pC(g)+qD(g)中,当m、n、p、q为任意正整数时,达到平衡的标志是( )
pC(g)+qD(g)中,当m、n、p、q为任意正整数时,达到平衡的标志是( )
A.体系压强不再发生变化
B.各组分的物质的量浓度不再改变
C.各组分的质量分数不再改变
D.反应速率vA∶vB∶vC∶vD=m∶m∶p∶q
6.在相同条件下(T=500K),有相同体积的甲、乙两容器,甲容器中充入1gSO2和1gO2,乙容器充入2gSO2和2gO2.下列叙述错误的是( )
A.化学反应速率:乙>甲 B.平衡后O2的浓度:乙>甲
C.平衡后SO2的转化率:乙>甲 D.平衡后SO2的体积分数:乙>甲
7.在423K时,容积相同的密闭容器①和②中,同时分别加入amol及bmolHI(a>b),并进行反应:2HI(g)
![]() I2(g)+H2(g).当达到平衡时,下列说法正确的是( )
I2(g)+H2(g).当达到平衡时,下列说法正确的是( )
A.平衡时I2的浓度c(I2)①=c(I2)②
B.平衡时I2蒸气在混合气体中的体积百分含量φ①>φ②
C.HI的平衡分解率α①=α②
D.从反应开始到达平衡,所需时间t①>t②
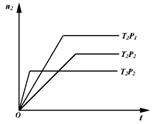
8.反应2X(g)+Y(g) ![]() 2Z(g)(正反应放热),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(n2)与反应时间(t)的关系如下图所示.下述判断正确的是( )
2Z(g)(正反应放热),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(n2)与反应时间(t)的关系如下图所示.下述判断正确的是( )
A.T1<T2,P1<P2 B.T1<T2,P1>P2
C.T1>T2,P1>P2 D.T1>T2,P1<P2
9.在1只固定容积的密闭容器中,放入3L气体X和2L气体Y,在一定条件下发生了下列反应:4X(g)+3Y(g)
![]() 2Q(g)+nR(g)达平衡后,容器内温度不变,混合气体的压强比原来增大了5%,X的浓度减小1/3.则此反应中的n值是( )
2Q(g)+nR(g)达平衡后,容器内温度不变,混合气体的压强比原来增大了5%,X的浓度减小1/3.则此反应中的n值是( )
A.3 B.4 C.5 D.6
10.某温度下,反应N2O4(g) ![]() 2NO2(g)-Q在密闭容器中达到平衡.下列说法不正确的是( )
2NO2(g)-Q在密闭容器中达到平衡.下列说法不正确的是( )
A.加压时(体积变小),将使正反应速率增大
B.保持体积不变,加入少许NO2,将使正反应速率减小
C.保持体积不变,加入少许N2O4,再达平衡时,颜色变深
D.保持体积不变,升高温度,再达平衡时颜色变深
11.将固体NH4I置于密闭容器中,在某温度下发生下列反应:NH4I(s)
![]() NH3(g)+HI(g),2HI(g)
NH3(g)+HI(g),2HI(g) ![]() H2(g)+I2(g),当反应达到平衡时,[H2]=0.5mol/L [HI]=4mol/L,则NH3的浓度为( )
H2(g)+I2(g),当反应达到平衡时,[H2]=0.5mol/L [HI]=4mol/L,则NH3的浓度为( )
A.3.5mol/L B.4.0mol/L C.4.5mol/L D.5.0mol/L
12.将2molPCl3和1molCl2充入一容积不变的密闭容器中,在一定条件下反应:PCl3(g)+Cl2(g) ![]() PCl5(g)达平衡时,PCl5为0.4mol.那么,在同体积容器中充入1molPCl3和0.5molCl2,在相同温度下,达平衡时PCl5的物质的量是( )
PCl5(g)达平衡时,PCl5为0.4mol.那么,在同体积容器中充入1molPCl3和0.5molCl2,在相同温度下,达平衡时PCl5的物质的量是( )
A.0.2mol B.小于0.2mol
C.大于0.2mol而小于0.4mol D.0.4mol
13.在一定条件下,某密闭容器发生反应:2SO2(g)+O2(g) ![]() 2SO3(g)+Q反应平衡后,SO2、O2、SO3的物质的量之比为3∶2∶4.其它条件不变,升高温度,达到新的平衡时n(SO2)=1.4mol,n(O2)=0.9mol,则此时SO3物质的量为( )
2SO3(g)+Q反应平衡后,SO2、O2、SO3的物质的量之比为3∶2∶4.其它条件不变,升高温度,达到新的平衡时n(SO2)=1.4mol,n(O2)=0.9mol,则此时SO3物质的量为( )
A.1.4mol B.1.6mol C.1.8mol D.2.0mol
14.在密闭容器中充入X、Y两种物质各2mol,发生如下反应:
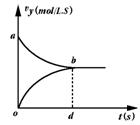
X(g)+Y(g)
![]() 2Z(g)
2Z(g)
当反应达到平衡后,以Y的浓度改变表示的反应速率v正、v逆与时间t的关系如图.如果容器的容积固定为2L,则Y的平衡浓度的表达式(式中S指对应区域的面积)为( )
A.2-Saob B.1-Saob C.2-Sabd D.1-Sbod
二、填空题
15.反应2NO2(g) ![]() N2O4(g)+56.9kJ的平衡体系中,在298K时,平衡常数为K1,在273K时,平衡常数为K2,在373K时平衡常数为K3,那么K1、K2、K3之间的数量大小关系是
.
N2O4(g)+56.9kJ的平衡体系中,在298K时,平衡常数为K1,在273K时,平衡常数为K2,在373K时平衡常数为K3,那么K1、K2、K3之间的数量大小关系是
.
16.难溶的银盐中,醋酸银(AgAc)溶解度相对较大.当V1mLamol·L-1NaAc溶液和V2mLamol·L-1AgNO3溶液混合发生反应时,欲使得AgAc的沉淀质量较接近理论值,则V1和V2的关系应是 ,理由是 .
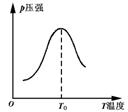
17.将1mol气体x和1mol气体y充入反应器中,在催化剂存在下发生了反应x(g)+y(g)![]() z(g).在反应过程中,产物z的压强(p)变化如下图所示.试判断该反应的正反应是 热反应.
z(g).在反应过程中,产物z的压强(p)变化如下图所示.试判断该反应的正反应是 热反应.
18.反应CaCO3![]() CaO+CO2在不同温度下密闭容器中达到平衡时的压强如下表:
CaO+CO2在不同温度下密闭容器中达到平衡时的压强如下表:
| 温度(℃) | 550 | 650 | 750 | 850 | 897 |
| 压强(Pa) | 5.32×101 | 9.17×102 | 8.37×103 | 4.94×104 | 1.01×105 |
请按要求填空:
(1)若升高原CaCO3分解平衡体系的温度,同时缩小反应容器体积,则原平衡 (填序号).
A.向左移动 B.向右移动
C.不移动 D.无法确定平衡移动方向
(2)在一个与外界不能进行热交换的密闭容器中,足量的CaCO3在850℃时建立了分解平衡,若将该容器的体积扩大为原来的2倍,当重新达到平衡时,容器内的温度将 (填“升高”“降低”或“无法确定”);平衡时容器内的压强将 (填“大于”“小于”或“等于”或“无法确定”)4.94×104Pa,理由是 .
19.两个极易导热的材料做成的体积相等的容器A和B,A是密闭定容的,B带上下可移动的活塞(气体不渗漏).在等温下向A、B两容器中充入等物质的量的N2O4固体并使之迅速气化.
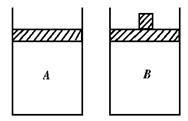
(1)在两容器内N2O4刚刚全部气化的时刻(温度相同),两容器生成NO2的速率A
B(大于、小于、等于)
(2)反应进行的某时刻t1(s)时,两容器生成NO2的速率A B(大于、小于、等于),理由是 .
(3)当两容器内都达到平衡时,N2O4的转化率A B,理由是 .
20.合成氨工业中原料气(N2、H2、CO的混合气)在进入合成塔前常用醋酸二氨合铜(I)溶液来吸收原料气中的CO,反应是:
[Cu(NH3)2]Ac+CO![]() [Cu(NH3)2]Ac·CO+QkJ
[Cu(NH3)2]Ac·CO+QkJ
(1)必须除去原料气中CO的原因是 .
(2)醋酸二氨合铜(I)吸收CO的生产适宜条件是 .
(3)吸收CO后的醋酸铜氨溶液经过适当处理又可再生,恢复其吸收CO的能力.醋酸铜氨再生的生产适宜条件是 .
三、计算题
21.某温度时,将12gNO和一定量的O2放在容积为8L的密闭容器内反应,反应刚开始测得气体混合物的压强为2×105Pa,达到平衡时测得混合气体的压强为1.5×105Pa,同时剩有O21.6g.求该温度下一氧化氮的转化率.
22.某温度下SO2的转化反应的平衡常数K=532.4.
2SO2+O2![]() 2SO3
2SO3
下面三个混合体系中各物质的浓度如下表.试判断各体系中反应进行的方向:
| 体系 | c(SO2)/mol·L-1 | c(O2)/mol·L-1 | c(SO3)/mol·L-1 | 反应方向 |
| (1) | 0.0600 | 0.400 | 2.000 | |
| (2) | 0.0960 | 0.300 | 0.500 | |
| (3) | 0.0862 | 0.263 | 1.020 |

参考答案:
【同步达纲练习】
一、1.A 2.D 3.D 4.B 5.BC 6.D 7.C 8.C 9.D 10.B 11.D 12.B 13.A 14.B
二、15.K2>K1>K3
16.v1≠v2;增大Ag+或Ac-的浓度,都有利于平衡向正反应方向移动,降低AgAc的溶液度.
17.放
18.(1)D (2)降低;小于;容积扩大为原来的2倍的瞬间,p=![]() =2.47×104(Pa),减小压强将使平衡右移,故温度将降低;平衡移动的结果将使压强增大,但总满足2.47×104Pa<P<4.94×104Pa
=2.47×104(Pa),减小压强将使平衡右移,故温度将降低;平衡移动的结果将使压强增大,但总满足2.47×104Pa<P<4.94×104Pa
19.(1)等于 (2)大于;N2O4![]() 2NO2的反应是气体体积增大的反应,A容器定容,B容器定压,随着反应的进行PA>PB,所以vA>vB (3)小于;随着反应的进行,PA始终大于PB,压强大,平衡向逆方向移动,故转化率A>B.
2NO2的反应是气体体积增大的反应,A容器定容,B容器定压,随着反应的进行PA>PB,所以vA>vB (3)小于;随着反应的进行,PA始终大于PB,压强大,平衡向逆方向移动,故转化率A>B.
20.(1)防止催化剂中毒失效 (2)低温、高压 (3)高温、低压
三、21.75% 22.(1)逆方向进行 (2)正方向进行 (3)反应已达平衡状态
