镁铝铁练习
班级 姓名
1、下面不能由单质直接化合而得到的化合物是 ( )
A、FeCl2 B、Al2S3 C、FeS D、Fe3O4
2、能直接由金属单质与酸反应得到的盐是 ( )
A、Fe(NO3)3 B、CuCl2 C、FeCl3 D、AgCl
3、下列性质的比较中,错误的是 ( )
A、熔沸点K>Na>Li B、原子半径Ca>Mg>Al C、活动性K>Ca>Na D、氧化性Ag+>Cu2+>Mg2+
4、要使氯化铝溶液中的Al3+完全转化成Al(OH)3,沉淀,应选用的适宜试剂是( )
A、NaOH溶液 B、稀HCl C、氨水 D、AgNO3溶液
5、往下列物质的溶液中通入CO2气体,有白色沉淀产生的是( )
A、MgCl2 B、Al(NO3)3 C、CaCl2 D、NaAlO2
6、在1mol/LAlCl3 100mL溶液中,加入2mol/L的氢氧化钠溶液,生成白色沉淀0.05mol,则加入的NaOH溶液的体积(mL)为( )
A.75 B.350 C.150 D.175
7、在Al(OH)3的悬浊液中,加入(或通入)下列物质,不能使其变澄清的是:( )
A.浓氨水 B.浓NaOH溶液 C.浓HNO3溶液 D.CO2
8、将溶液中的Mg2+、Al3+分离,可选用的试剂是( )
A、氨水 B、NaOH与HNO3 C、盐酸 D、K2CO3溶液
9、两种金属的混合粉末30g,跟足量稀硫酸反应时,恰好得到22.4L氢气(标况).下列各组金属不能构成上述条件混合物的是:( )
![]() A.Al和Cu
B.Zn和Ag
C.Mg和Al D.Al和Fe
A.Al和Cu
B.Zn和Ag
C.Mg和Al D.Al和Fe

![]()
![]() 10、向一无色透明的溶液中滴加稀硫酸时有沉淀生成,且所得沉淀量与所加硫酸的关系如图所示,则原溶液可能是(
)
10、向一无色透明的溶液中滴加稀硫酸时有沉淀生成,且所得沉淀量与所加硫酸的关系如图所示,则原溶液可能是(
)
(A)![]() 的混合溶液
的混合溶液
![]() (B)
(B)![]() 的混合溶液
的混合溶液
![]()
|
(D)![]() 的混合溶液
的混合溶液
11.下列图中,能表示将氢氧化钡溶液逐滴加入到硫酸铝溶液中,产生沉淀的质量Wg与加入氢氧化钡溶液的体积VmL关系的是( )
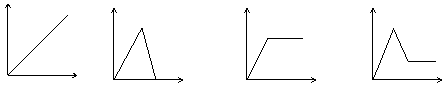
![]() W
W
W
W
W
W
W
W
V V V V
A B C D
12、下列离子方程式书写正确的是 ( )
A、碳酸氢钙溶液中加入过量的氢氧化钠溶液 HCO3— + OH— = CO32— + H2O
B、在澄清石灰水中通入过量二氧化碳 OH- +CO2=HCO3-
C、次氯酸钙溶液中通人过量二氧化碳 Ca2+ + 2ClO-+H2O+CO2 = CaCO3↓+2HClO
D、氯化亚铁溶液中加入硝酸 3Fe2+ + 4H+ + NO3— = 3Fe3+ + 2H2O + NO↑
13、用一种试剂就可以将NaOH、NH4SCN、AgNO3、Na2SO4四种无色溶液一一鉴别出来,这种试剂是
A、溴水 B、FeCl3 C、Fe(NO3)3 D、BaCl2
14、下列各组离子在强酸性、无色透明溶液中能大量共存的是( )
A、K+、Fe3+、SO42-、Cu2+ B、K+、NO3-、AlO2-、Na+
C、NH4+、Al3+、SO42-、NO3— D、Fe3+、SO32-、Na+、S2-
15、向含1molKAl(SO4)2的溶液中加入适量的Ba(OH)2溶液,使溶液中的SO42- 恰好完全沉淀, 则最后生成Al(OH)3的物质的量是( )
A、1mol B、1.33mol C、0.667mol D、0mol
16、将5.6g铁粉加入0.3mol销酸铁的溶液中,充分反应后( )
A、Fe3+全部被还原 B、Fe3+部分被还原,Fe全部被氧化 C、Fe部分被氧化 D、溶液中只有Fe2+
二、填空题
17、镁条在空气中燃烧,其反应的化学程式是 、
、 ;
18、含有较多Fe2+的溶液呈 色,含有较多Fe3+的溶液呈 色。往FeSO4的水溶液中滴加氨水,开始看到的现象是 ,离子方程式为 。生成的难溶物在空气中露置后,继续看到的现象是 。反应的离子方程式为 。加热上述反应最后生成的难溶物,反应的化学方程式是 。
19、铝片溶于热的烧碱溶液,反应的离子方程式为 ,该反应中氧化剂是 。向反应后的溶液中滴加入稀硫酸,最初的实验再象为 ,后来的实验现象为 ,上述现象相应反应的离子方程分别为 、
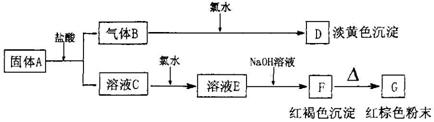 20、有A、B、C、D、E、F、G七种物质,它们的变化关系如下图所示:
20、有A、B、C、D、E、F、G七种物质,它们的变化关系如下图所示:
(1) 写出下列物质化学式:
A B
E F G ;
(2)写出下列变化的离子方程式:
A→B+C: ; C→E:
21、把镁粉放入溴水中,可观察到溴水褪色同时有气泡产生,可能发生的化学反应的化学方程式为:
(1)___________________________ (2)___________________________
(3)___________________________
过滤后,将滤液分成两份,一份加入氨水,现象是 反应的离子方程式为__________________________;另一份加入硝酸银溶液,现象是__ _______________反应的离子方程式为___ _________________.
22、将Al3+、Na+、K+、NO3-、OH-、S2-、MnO4-、Fe3+、NH4+、H+、AlO2-、CO32-按在溶液中可以大量共存的情况分成两组.第一组有四种阳离子和两种阴离子,它们是 ;第二组有四种阴离子和两种阳离子,它们是 .
三、计算题
23、向100mL0.1mol/L的AlCl3溶液中滴加NaOH溶液,当滴加碱液800mL时,恰好完全反应得到澄清的溶液,求NaOH溶液的物质的量浓度。
答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| A | A | A | C | D | AD | AD | B | BC | A | D | BD | B | C | D | B |
17、2Mg + O2 ![]() 2MgO 3Mg +
N2
2MgO 3Mg +
N2 ![]() Mg3N2 2Mg + CO2
Mg3N2 2Mg + CO2 ![]() 2MgO + C
2MgO + C
18、浅绿色;黄色;产生白色絮状沉淀;Fe2+ + 2 NH3·H2O== Fe(OH)2
↓+ 2 NH4+ ;白色沉淀迅速变为灰绿色,最后变为红褐色;4 Fe(OH)2 + O2
+ 2H2O == 4 Fe(OH)3 ;
2 Fe(OH)3 ![]() Fe2O3 +3 H2O
Fe2O3 +3 H2O
19、2Al+2OH-+2H2O== 2AlO2-+3 H2↑;H2O ;产生白色胶状沉淀 ;沉淀溶解;AlO2-+H++H2O=Al(OH)3↓
Al(OH)3 +3H+ == Al3+ +3H2O
20(1):FeS,H2S,FeCl3,Fe(OH)3,Fe2O3
(2)FeS+2H+==Fe2+ + H2S↑ 2Fe2+ + Cl2 = 2Fe3+ + 2 Cl-
21、Br2 +Mg = MgBr2 Mg +2HBr = MgBr2 + H2↑ Br2 +H2O == HBr + H BrO ,产生白色絮状沉淀,Mg2+ +2NH3·H2O = Mg(OH)↓+ 2NH4+ ,淡黄色沉淀,Ag+ + Br- == AgBr↓
22、H+、NH4+、Fe3+、Al3+、MnO4-、NO3- ;OH-、S2-、Na+、K+、CO32-、AlO2-
23、0.05mol/L