酸碱中和滴定
1. 用标准盐酸测定氨水的浓度,最适宜使用的指示剂是( )
A. 甲基橙 B. 酚酞 C. 石蕊 D. 以上均可
2. 进行中和滴定时,事先不应该用所盛溶液润洗的仪器是( )
A. 酸式滴定管 B. 碱式滴定管 C. 锥形瓶 D. 量筒
3. 用标准的![]() 溶液滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是( )
溶液滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是( )
A. 配制标准溶液的氢氧化钠中混有![]() 杂质
杂质
B. 滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C. 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
4. 用已知浓度的盐酸来测定某![]() 溶液的浓度,若配制
溶液的浓度,若配制![]() 溶液时所用
溶液时所用![]() 中分别含有
中分别含有
(1)![]() (2)
(2)![]() (3)
(3)![]() (4)
(4)![]()
杂质时,所测结果偏低的是( )
A. (1) B. (2) C. (2)与(3) D. (2)(3)(4)
5. 为测定苛性钾的纯度,取样品![]() 溶于水配制成1 L溶液,取此溶液
溶于水配制成1 L溶液,取此溶液![]() ,用去
,用去![]() 溶液
溶液![]() ,恰好反应完全,则苛性钾的纯度为(杂质不与酸反应)( )
,恰好反应完全,则苛性钾的纯度为(杂质不与酸反应)( )
A. 96% B. 48% C. 9.6% D. 56%
6. 把一种一定浓度的![]() 溶液分成两等份,一份密闭保存,另一份敞口放置,几天后用相同浓度的盐酸去中和它们,至溶液中只有
溶液分成两等份,一份密闭保存,另一份敞口放置,几天后用相同浓度的盐酸去中和它们,至溶液中只有![]() 时,若第一份用去盐酸
时,若第一份用去盐酸![]() ,第二份用去盐酸
,第二份用去盐酸![]() 。则
。则![]() 的关系正确的是( )
的关系正确的是( )
A. ![]() B.
B.
![]() C.
C.
![]() D.
不一定
D.
不一定
7. 将![]() 样品溶于
样品溶于![]()
![]() 中,再加
中,再加![]() 溶液恰好呈中性,则样品纯度为(杂质不与酸反应)( )
溶液恰好呈中性,则样品纯度为(杂质不与酸反应)( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
8. 用标准盐酸滴定一种由![]() 组成的混合溶液,以便确定各组分的含量。已知
组成的混合溶液,以便确定各组分的含量。已知![]() 时,
时,![]() 全部转变为
全部转变为![]() ,则滴定中选择的指示剂应为( )
,则滴定中选择的指示剂应为( )
A. 先用酚酞后用甲基橙 B. 先用酚酞后用石蕊
C. 先用石蕊后用甲基橙 D. 先用甲基橙后用酚酞
9. 取体积相同(![]() )的两份
)的两份![]()
![]() 溶液,把其中一份放在空气中一段时间后,溶液的
溶液,把其中一份放在空气中一段时间后,溶液的![]() __________________(填“增大”、“减小”或“不变”),其原因是______________________________________________________。用已知浓度的硫酸溶液中和上述两份溶液,若中和第一份(在空气中放置一段时间)所消耗硫酸溶液的体积为
__________________(填“增大”、“减小”或“不变”),其原因是______________________________________________________。用已知浓度的硫酸溶液中和上述两份溶液,若中和第一份(在空气中放置一段时间)所消耗硫酸溶液的体积为![]() ,另一份消耗硫酸溶液的体积为
,另一份消耗硫酸溶液的体积为![]() 。则(1)以甲基橙为指示剂时,
。则(1)以甲基橙为指示剂时,![]() 的关系是:____________________________________________。
的关系是:____________________________________________。
(2)以酚酞为指示剂时,![]() 的关系是:____________________________________
的关系是:____________________________________
_______。
10. 有一含![]() 的混合物,为了检测各成分的含量进行如下实验。
的混合物,为了检测各成分的含量进行如下实验。
(1)取此混合物![]() 溶于蒸馏水中配成
溶于蒸馏水中配成![]() 溶液,然后取出
溶液,然后取出![]() ,以甲基橙为指示剂,用
,以甲基橙为指示剂,用![]() 的盐酸标准溶液进行滴定,达到终点时消耗盐酸
的盐酸标准溶液进行滴定,达到终点时消耗盐酸![]() 。
。
(2)另取所配酸溶液20 ![]() ,先加
,先加![]() 溶液直到不再产生沉淀为止,过滤后取滤液,再以甲基橙为指示剂用上述盐酸进行滴定,达到终点时消耗盐酸15
溶液直到不再产生沉淀为止,过滤后取滤液,再以甲基橙为指示剂用上述盐酸进行滴定,达到终点时消耗盐酸15 ![]() 。根据这些数据计算原混合物中各成分的质量分数。
。根据这些数据计算原混合物中各成分的质量分数。
【试题答案】
1. A
提示:盐酸与氨水恰好完全反应时,生成![]() ,其水解溶液呈酸性。
,其水解溶液呈酸性。
2. CD 3. AD 4. D
5. A 6. B 7. B
8. A
9. 解析:![]() 溶液放置于空气中,因
溶液放置于空气中,因![]() 与空气中
与空气中![]() 反应,造成
反应,造成![]() 减少:
减少:
![]()
故溶液![]() 减小。
减小。
用![]() 滴定
滴定![]() 溶液,反应分两个阶段进行:
溶液,反应分两个阶段进行:
(1)![]() (此时溶液呈弱碱性)
(此时溶液呈弱碱性)
(2)![]() (此时溶液呈弱酸性)
(此时溶液呈弱酸性)
滴定过程中,按哪种反应进行,取决于选择的指示剂。
(1)若选用甲基橙作指示剂,因其变色范围在![]() ,反应按(2)进行,由关系式
,反应按(2)进行,由关系式
![]()
知,消耗的![]() 的量不变。故答案为
的量不变。故答案为![]() ;
;
(2)若选用酚酞作指示剂,酚酞的变色范围为![]() ,反应按(1)进行,消耗
,反应按(1)进行,消耗![]() 的量减少
的量减少
故答案为![]() 。
。
10. 解析:设![]() 溶液中
溶液中![]() 。
。
当以甲基橙作指示剂时,反应如下:
![]()
y y
![]()
2x x
依题意:
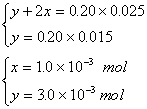
各组分的质量分数:
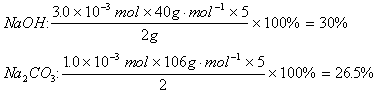
![]()