![]()
|
|
学科:化学 |
| 教学内容:第四节 氧化还原反应方程式的配平 |
【基础知识精讲】
1.氧化还原反应的实质
参加反应的原子间的电子转移(包括电子得失或共用电子对的偏移).
2.氧化还原反应的有关概念可从下列关系中归纳出来.

3.氧化还原反应方程式的配平
(1)配平依据
氧化剂化合价降低总数与还原剂化合价升高总数相等,即得失电子守恒和质量守恒.
(2)配平的步骤
标好价、列变化、求总数、配系数
(3)配平方法:化合价升降法、观察法、代数法、整体标价法等,其中最常见的是化合价升降法.
氧化还原方程式的配平方法很多,下面介绍几种配平策略和技巧:
1.自身反应,逆向配平
如果化合价有升降的元素是同一物质中的同种元素,或氧化剂、还原剂是同一种物质时,可从生成物的一边进行配平,首先确定氧化产物、还原产物的系数.
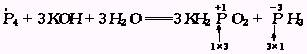
2.多种变价,合并计算
如果同一分子内有多种元素的化合价发生升降变化,可把这个分子当整体,合并计算此分子内化合价升高或降低的总值.
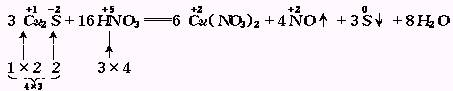
3.同种元素的化合价变化,只相邻不相交
同种元素间发生的氧化还原反应,化合价升降后一般变成相邻状态,或是同处于高价(氧化剂)和低价(还原剂)中间的某一价态,而不可能出现化合价的交叉现象,如![]() 和
和![]() 之间的变化,一般是
之间的变化,一般是![]()
![]()
![]() 、
、![]()
![]()
![]() ,也可能是
,也可能是![]()
![]()
![]()
![]()
![]() 或
或![]()
![]()
![]()
![]()
![]() ,但不可能是
,但不可能是![]()
![]()
![]() ,
,![]()
![]()
![]() ,更不可能是
,更不可能是![]()
![]()
![]() .
.
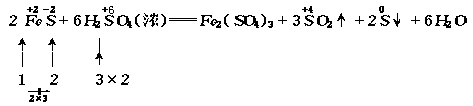
其中FeS中的![]() 被氧化成S,H2SO4中的
被氧化成S,H2SO4中的![]() 被还原为SO2,Fe2(SO4)3中的SO42-由H2SO4提供.
被还原为SO2,Fe2(SO4)3中的SO42-由H2SO4提供.
4.选准物质,跟踪配平
对某些复杂的分解反应和复杂有机物的燃烧和爆炸反应,可以选择复杂反应物,然后根据其各元素的原子数跟踪配平产物的系数(若系数出现分数,则要将其调整的为整数).
Fe(NO3)2![]()
![]() Fe2O3+2NO2+
Fe2O3+2NO2+![]() O2
O2
调整系数:4Fe(NO3)2![]() 2Fe2O3+8NO2+O2
2Fe2O3+8NO2+O2
【重点难点解析】
例1:已知氧化还原反应式:NaNO2+NH4Cl—NaCl+N2↑+H2O,若得到mmol的N2,则电子转移数为 个,此时氧化产物与还原产物的质量之比为 .
分析:从反应式可知NaNO2中![]() 被还原为零价,NH4Cl中
被还原为零价,NH4Cl中![]() 被氧化成零价,所以很快可以配平,即:NaNO2+NH4Cl
被氧化成零价,所以很快可以配平,即:NaNO2+NH4Cl![]() NaCl+N2↑+2H2O,当电子转移数目为3mNA,由上述分析知氧化产物与还原产物均为N2,物质的量之比为1∶1,故其质量比为1∶1.
NaCl+N2↑+2H2O,当电子转移数目为3mNA,由上述分析知氧化产物与还原产物均为N2,物质的量之比为1∶1,故其质量比为1∶1.
本题答案:3mNA 1∶1
例2:配平H2O2+Cr2(SO4)3+ —K2SO4+K2CrO4+H2O
分析:对于缺项方程式,一般情况下缺项为水、酸、碱.比如KMnO4、硝酸盐参与的反应一般在酸性条件下,如果没有酸,那么水应参与,这时产物中会出现碱.如果试题中有提示信息,则难度会大大降低.一般来说,可先配平含变价元素物质的系数,再通过比较反应物与生成物所含原子或离子种类来确定缺项物质的化学组成,然后将其配平.本题左边缺项物质应含K+,而含K+的物质不是H2O,一般也不为酸,故为KOH,然后将其配平.
本题答案:3H2O2+Cr2(SO4)3+10KOH![]() 3K2SO4+2K2CrO4+8H2O
3K2SO4+2K2CrO4+8H2O
例3:当Zn与某浓度的硝酸反应时,若参加反应的锌与硝酸的物质的量之比为2∶5时,则还原产物可能是( )
A.N2O B.NO C.NO2 D.N2O5 E.NH4NO3
分析:因为2Zn~5HNO3,不妨设用4mol Zn和10mol HNO3反应,4mol Zn失去电子4×2=8mol,而4mol Zn要生成4mol Zn(NO3)2,则应消耗HNO3 8mol,所以发生还原反应的硝酸可能有1mol或2mol.若2mol被还原,根据得失电子数相等的原则,则HNO3被还原为N2O.若1mol被还原,则还原产物为NH4NO3.
本题答案:AE
【难题巧解点拨】
例1:在反应:3BrF3+5H2O![]() HBrO3+Br2+9HF+O2中,当有5mol水参加反应时,由H2O还原的BrF3为
mol;由BrF3还原的BrF3为
mol;被还原的BrF3为
mol.
HBrO3+Br2+9HF+O2中,当有5mol水参加反应时,由H2O还原的BrF3为
mol;由BrF3还原的BrF3为
mol;被还原的BrF3为
mol.
分析:本题解答除需理解还原、被还原的概念,弄清电子转移关系外,还要认真审题,注意措辞,方能得到正确答案.
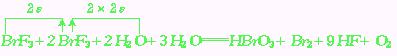
当有5mol水参加反应时,有6mol电子转移,其中由水还原的BrF3为4/3mol,由BrF3还原的BrF3为2/3mol,总的被还原的BrF3为(![]() mol+
mol+![]() mol)=2mol.
mol)=2mol.
例2:在反应:3BrF3+5H2O![]() HBrO3+Br2+9HF+O2中,当有5mol水作还原剂参加化学反应时,由水还原的BrF3为
mol;由BrF3还原的BrF3为
mol;总的被还原的BrF3为
mol.
HBrO3+Br2+9HF+O2中,当有5mol水作还原剂参加化学反应时,由水还原的BrF3为
mol;由BrF3还原的BrF3为
mol;总的被还原的BrF3为
mol.
分析:当有2mol水作还原剂时,由水还原的BrF3为4/3mol,现有5mol水作还原剂时,则由水还原的BrF3为10/3mol,由BrF3还原的BrF3为5/3mol,总的被还原的BrF3为5mol.
例3:在反应:3BrF3+5H2O![]() HBrO3+Br2+9HF+O2中,当有5mol水未参加氧化还原反应时,由水还原的BrF3为
mol;由BrF3还原的BrF3为
mol;总的被还原的BrF3为
mol.
HBrO3+Br2+9HF+O2中,当有5mol水未参加氧化还原反应时,由水还原的BrF3为
mol;由BrF3还原的BrF3为
mol;总的被还原的BrF3为
mol.
分析:当有3mol水未参加氧化还原反应时,由H2O还原的BrF3为4/3mol,现有5mol水未参加氧化还原反应,则被水还原的BrF3为![]() mol×
mol×![]() =
=![]() mol,由BrF3还原的BrF3为10/9mol,总的被还原的BrF3为(
mol,由BrF3还原的BrF3为10/9mol,总的被还原的BrF3为(![]() mol+
mol+![]() mol)=
mol)=![]() mol.
mol.
【命题趋势分析】
本节考点有两个,一是氧化还原化学方程式的配平,二是有关氧化还原反应的计算.
【典型热点考题】
1.氢化钙可以作为生氢剂,反应方程式如下:CaH2+2H2O![]() Ca(OH)2+2H2↑其中水的作用是( )
Ca(OH)2+2H2↑其中水的作用是( )
A.既不是氧化剂也不是还原剂 B.是氧化剂
C.是还原剂 D.既是氧化剂又是还原剂
本题参考答案:B
2.现有化学方程式:
aFeCl2+bKNO3+cHCl![]() dFeCl3+eKCl+fX+gH2O;若3b=a=3,X为还原产物,其分子式应该是( )
dFeCl3+eKCl+fX+gH2O;若3b=a=3,X为还原产物,其分子式应该是( )
A.NO2 B.NO C.N2O D.NH3
本题参考答案:B
3.(NH4)2SO4在强热条件下,可分解生成NH3、SO2、N2、H2O.反应中氧化产物和还原产物的物质的量之比为( )
A.1∶3 B.2∶3 C.3∶1 D.4∶3
本题参考答案:A
4.将K2S跟HNO3反应,生成NO、S、KNO3、H2O,反应的化学方程式为 ,如生成2molNO,反应中电子转移的总物质的量为 mol,氧化产物是 .
本题参考答案:3K2S+8HNO3![]() 6KNO3+2NO↑+3S↓+4H2O 6mol S
6KNO3+2NO↑+3S↓+4H2O 6mol S

【同步达纲练习】
一、配平下列反应的化学方程式,并指出哪种物质是氧化剂,它的氧化产物是什么?
(1)KMnO4+HCl(浓)—MnCl2+KCl+Cl2+H2O
, .
(2)C+HNO3(浓)—CO2+NO2+H2O
, .
(3)S+HNO3(浓)—H2SO4+NO2+H2O
, .
(4)NH4NO3—N2O+H2O
, .
(5)KMnO4+H2O2+H2SO4—K2SO4+MnSO4+O2+H2O
, .
(6)FeS2+O2—Fe2O3+SO2
, .
(7)As2S3+HNO3+ —H3AsO4+H2SO4+NO
, .
(8)KI+KIO3+H2SO4—I2+K2SO4+H2O
, .
(9)NH3+Cl2—NH4Cl+N2
, .
(10)Zn+HNO3—Zn(NO3)2+NH4NO3+H2O
, .
2.(NH4)2PtCl6晶体受热完全分解,生成氮气、氯化氢、氯化铵和铂.在此分解反应中,氧化产物和还原产物的物质的量之比为( )
A.1∶2 B.2∶3 C.3∶4 D.3∶2
3.R2O8n-在一定条件下可把Mn2+离子氧化为MnO4-,而R2O8n-离子变成RO42-.又知反应中氧化剂和还原剂的物质的量之比为5∶2,则n值为( )
A.4 B.3 C.2 D.1
4.现有反应:xKI+yKIO3+zH2SO4![]() aI2+bK2SO4+cH2O,其中x+y+z与a+b+c的关系是( )
aI2+bK2SO4+cH2O,其中x+y+z与a+b+c的关系是( )
A.大于 B.小于 C.等于 D.不能确定
5.用0.1mol·L-1的Na2SO3溶液30mL,恰如将2×10-3mol的XO4-离子还原,则元素X在还原产物中的化合价是( )
A.+1 B.+2 C.+3 D.+4
6.在5NH4NO3![]() 2HNO3+4N2+9H2O的反应中,被氧化的氮元素与被还原的氮元素的物质的量之比为( )
2HNO3+4N2+9H2O的反应中,被氧化的氮元素与被还原的氮元素的物质的量之比为( )
A.3∶5 B.5∶3 C.5∶4 D.4∶5
7.在一定条件下,1mol硝酸铵可分解成0.4mol硝酸和1.8mol水以及另外一种气态物质,此物质是( )
A.NO B.N2O C.N2 D.N2O3
8.在氧化还原反应:
KI+5KIO3+3H2S![]() 3K2SO4+3I2+3H2O
3K2SO4+3I2+3H2O
被氧化的碘元素和被还原的碘元素的质量比是 ,氧化剂是 ,还原剂是 .
9.在氧化还原反应:
3Cu2S+16HNO3![]() 6Cu(NO3)2+2S+4NO↑+8H2O被氧化的元素是
,氧化产物是
,在反应中起氧化剂和还原剂作用的物质的物质的量之比为
.
6Cu(NO3)2+2S+4NO↑+8H2O被氧化的元素是
,氧化产物是
,在反应中起氧化剂和还原剂作用的物质的物质的量之比为
.
10.将H2S跟浓HNO3溶液反应,当HNO3过量时,H2S的氧化产物是H2SO4,反应物HNO3的还原产物是NO,生成物中还有水,写出这一反应的化学方程式 .
如反应中有2.4mol电子转移时,生成的NO在标准状况下的体积是 L,这些NO全部被氧化为NO2,需O2的体积为 L(标准状况).
11.在MnO2和浓盐酸的反应中,如果有17.4g100%的MnO2被还原,那么参加反应的氯化氢有多少克?被氧化的氯化氢是多少克?
【素质优化训练】
1.氯酸是一种强酸,在氯酸溶液中,当其质量分数超过40%时,它就会迅速分解,产生一种更强的酸,同时产生A、B两种气体,它们的物质的量之比为15∶8,实验证明,A能使余烬木条复燃,B能使湿润的淀粉KI试纸变蓝.试写出氯酸分解的化学方程式 .
2.二氧化氯(ClO2)是一种黄色气体,大量用于水的净化和纤维素的漂白.在实验室,二氧化氯的制取是将氯酸钠和亚硫酸钠分别倒入烧瓶中,用水浴加热,同时滴入硫酸溶液,即产生二氧化氯.试写出该反应的化学方程式 .每生产0.1mol的二氧化氯时,被氧化的亚硫酸钠为 mol.
3.已知RxO42-+MnO4-+H+—RO2+Mn2++H2O的变化过程中,有0.2molRxO42-离子参加反应时,共转移0.4mol电子.
(1)反应的氧化产物为 ;
(2)x= ;
(3)参加反应的氢离子的物质的量为 .
4.在氯酸钾的分解反应里,二氧化锰的催化问题,到目前还没有肯定的解释.鉴于制得的氧气中有氯气的气味,生成的氯化钾又略显紫红色,认为反应过程如下(已配平):
Ⅰ.2KClO3+2MnO2![]() 2A+B↑+C↑
2A+B↑+C↑
Ⅱ.2A![]() D+MnO2+C↑
D+MnO2+C↑
Ⅲ.B+D![]() 2KCl+ +C↑
2KCl+ +C↑
(1)反应Ⅰ中氧化产物是(填化学式) .
(2)反应Ⅲ的化学反应方程式是 .
(3)按上述反应过程,若制取1.5mol氧气,总共有 mol电子发生转移.
(提示:由三个方程式各制取![]() ×1.5mol=0.5mol氧气转移的电子数之和可得).
×1.5mol=0.5mol氧气转移的电子数之和可得).
5.G、Q、X、Y、Z均为氯的含氧化合物,我们不了解它们的化学式,但知道它们在一定条件下具有如下的转换关系(未配平):
①G![]() Q+NaCl
Q+NaCl
②Q+H2O![]() X+H2
X+H2
③Y+NaOH![]() G+Q+H2O
G+Q+H2O
④Z+NaOH![]() Q+X+H2O
Q+X+H2O
这五种化合物中氯的化合价由低到高的顺序为:
6.若NO2与水反应时得到2mol硝酸,被氧化的NO2的物质的量是 mol,其质量是 g,该溶液质量增加了 g.
7.在KClO3+6HCl![]() KCl+3Cl2↑+3H2O的反应中,当有6×6.02×1023个电子发生转移时,被氧化的氯原子与被还原的氯原子个数比为
.
KCl+3Cl2↑+3H2O的反应中,当有6×6.02×1023个电子发生转移时,被氧化的氯原子与被还原的氯原子个数比为
.
8.高锰酸钾和氢溴酸溶液可以发生如下反应:KMnO4+HBr![]() Br2+MnBr2+KBr+H2O 其中还原剂是 .若消耗0.1mol氧化剂,则被氧化的还原剂的物质的量是
mol.
Br2+MnBr2+KBr+H2O 其中还原剂是 .若消耗0.1mol氧化剂,则被氧化的还原剂的物质的量是
mol.
9.铜跟稀硝酸反应时,如果有1molHNO3被还原,则被氧化的铜的质量是 g.如果有1.5mol铜发生反应,则需消耗的HNO3为 mol.如果有32g铜被氧化,则必然有 molHNO3被还原.如果生成的一氧化氮在标准状况下的体积是2.24L,则应有 mol电子发生转移.
10.阅读古诗于谦的《石灰吟》,回答下面问题
《石灰吟》
于 谦
千锤万凿出深山,
烈火焚烧若等闲.
粉身碎骨浑不怕,
要留清白在人间.
(1)“千锤万凿出深山”,开凿的物质是( )
A.石灰石 B.铁矿石 C.脉石 D.重晶石
(2)“千锤万凿出深山”说明开采的物质( )
A.硬度高难于开采
B.属原子晶体
C.属离子晶体
D.古代没有机械化采矿设备,无法开采任何矿石,诗中的物质是诗人的想象
(3)关于“烈火焚烧若等闲”对应的反应说法中,正确的是( )
A.属于氧化还原反应 B.产生的气体可造成温室效应
C.属于分解反应 D.属于置换反应
(4)写出所对应的反应的化学方程式,其中属于化合反应的是 ,分解反应的是 .
【生活实际运用】
铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,它的氧化性比KMnO4强,本身在反应中被还原为Fe3+离子达到净水的目的.它是由Fe(NO3)3、NaOH和Cl2在一定条件下制得的,同时还有NaNO3、NaCl等生成,写出其反应的化学方程式 .制Na2FeO4的反应中
元素被氧化,转移电子总数是 .

答案:
【同步达纲练习】
1.(1)2;16;2;2;5;8;KMnO4;Cl2 (2)1;4;1;4;2;浓HNO3;CO2 (3)1;6;1;6;2;浓HNO3;H2SO4 (4)1;1;2;NH4NO3;N2O (5)2;5;3;1;2;5;8;KMnO4;O2 (6)4;11;2;8;O2;Fe2O3;SO2 (7)3;28;4H2O;6;9;28;HNO3;H3AsO4;H2SO4 (8)5;1;3;3;3;3;KIO3;I2 (9)8;3;6;1;Cl2;N2 (10)4;10;4;1;3;HNO3;Zn(NO3)2
2.B 3.C 4.C 5.D 6.B 7.C 8.1∶5;KIO3;KI 9.Cu、S,Cu(NO3)2、S;4∶3
10.3H2S+8HNO3![]() 3H2SO4+8NO↑+4H2O; 17.92; 8.96 11.29.2;14.6
3H2SO4+8NO↑+4H2O; 17.92; 8.96 11.29.2;14.6
【素质优化训练】
1.26HClO3![]() 10HClO4+15O2↑+8Cl2↑+8H2O
10HClO4+15O2↑+8Cl2↑+8H2O
2.2NaClO3+Na2SO3+H2SO4![]() 2ClO2↑+2Na2SO4+H2O 0.05
2ClO2↑+2Na2SO4+H2O 0.05
3.(1)RO2 (2)2 (3)0.64mol
4.(1)KMnO4、O2 (2)Cl2+K2MnO4![]() 2KCl+MnO2+O2↑ (3)9
2KCl+MnO2+O2↑ (3)9
5.G、Y、Q、Z、X
6.2mol,92g,108g
7.5∶1
8.HBr,0.5mol
9.96g,4mol,1/3mol,0.3mol
10.(1)A (2)A、C,CaCO3属离子晶体 (3)B、C CaCO3![]() CaO+CO2↑ (4)CaO+H2O
CaO+CO2↑ (4)CaO+H2O![]() Ca(OH)2 CaCO3
Ca(OH)2 CaCO3![]() CaO+CO2↑
CaO+CO2↑
【生活实际运用】
2Fe(NO3)3+16NaOH+3Cl2![]() 2Na2FeO4+6NaNO3+6NaCl+8H2O;
2Na2FeO4+6NaNO3+6NaCl+8H2O;
Fe3+;6e
