高二下学期化学期末考试
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共120分,考试时间100分钟。
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24
Al:27 Si:28 Cl:35.5 Ca:40 Cu:64 Ag:108
第Ⅰ卷(选择题 共60分)
一、选择题:(本题包括4小题,每小题3分,共12分。每小题只有一个选项符合题意。)
1. 环境问题关系到人类的生存和发展,保护环境就是保护人类自己。从保护环境的角度出发,目前最有发展前景的一次性餐具是
A. 瓷器餐具 B. 塑料餐具 C. 淀粉餐具 D. 不锈钢餐具
2. 新兴大脑营养学研究发现,大脑生长发育与不饱和脂肪酸有密切关系。从深海鱼油中提取的,被称作“脑黄金”的DHA就是一种不饱和度很高的脂肪酸。它的分子含6个碳碳双键,学名二十六碳六烯酸。它的分子组成应是
A. C25H50COOH B. C25H39 COOH C. C26H41 COOH D. C26H47 COOH
3. 城市居民使用的石油液化气的主要成分是丁烷,在使用过程中,常有一些杂质以液态沉积于钢瓶内,这些杂质是
A. 丙烷和丁烷 B. 乙烷和丙烷 C. 乙烷和戊烷 D. 戊烷和已烷
4. 下列四种分子式所表示的化合物中,有多种同分异构体的是
A. CH4O B. C2HCl5 C. C2H4Cl2 D. CH2O2
二、选择题:(本题包括12小题,每小题4分,共48分。每小题只有一个选项符合题意。)
5. 白藜芦醇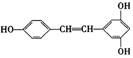 广泛存在于食物中(例如桑堪、花生,尤其是葡萄干),它右能具有抗癌性。能够跟1mol该化合物起反应的Br2或H2的最大用量分别是
广泛存在于食物中(例如桑堪、花生,尤其是葡萄干),它右能具有抗癌性。能够跟1mol该化合物起反应的Br2或H2的最大用量分别是
A. 1mol,1mol B. 3.5 mol,7 mol C. 6 mol,6 mol D. 6 mol,7 mol
6. 美日科学家因发现“导电聚合物”而荣获2000年诺贝尔化学奖。这种导电聚合物是把塑料经过改造后,其内部的C原子之间交替地以单键和双键结合(再经掺杂处理)。这类聚合物在21世纪将制成可折叠式电视屏幕、可穿在身上的计算机、会发光的墙纸等,成为物理学家和化学家十分关注的研究领域。下列聚合物经掺杂处理后可制成“导电塑料”的是
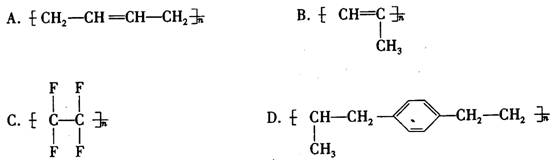
7. 乙知甲醛(HCHO)分子中的4个原子是共平面的。下列分子中所有原子不可能同时存在于同一平面上的是

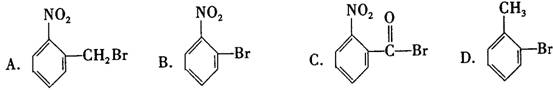
8. 已知酸性大小,羧酸>碳酸>酚。下列含溴原子,在适当条件下都能被羟基(—OH)取代(均可称为水解反应),所得产物能跟NaHCO3溶液反应的是
9. 某有机物A在NaOH溶液中发生水解反应,生成B和C,B在一定条件下氧化得D,D进一步氧化生成E,D、E都能发生银镜反应,C与盐酸作用生成F,F与E互为同系物,且F位于E的次一次,所以A是
A. 蔗糖 B. 甲酸甲酯 C. 甲酸乙酯 D. 乙酸甲酯
10. 用NA表示阿伏加德罗常数的值,下列叙述中正确的是
A. 标准状况下,1L庚烷完全燃烧后,所生成的气态产物的分子数为![]() NA
NA
B. 1 mol碳正离子CH5+所含的电子总数为10NA
C. 标准状况下,16g甲烷完全燃烧所消耗的氧气的分子数为2 mol
D. 1 molNa2O2固体跟足量CO2气体完全反应,转移2NA个电子
11. 将11.2mL甲醛气体溶解在5mL甲酸甲酯中,若再加入1.8g葡萄糖,所得溶液中氧元素的质量分数是
A. 53.3% B. 40% C. 24% D. 12%
12. 反应4A(气)+6B(气)![]() 4C(气)+5D(气)在2L的密闭容器中进行,1min后A气体减少了0.12mol,则平均每秒中浓度变化正确的是
4C(气)+5D(气)在2L的密闭容器中进行,1min后A气体减少了0.12mol,则平均每秒中浓度变化正确的是
A. B气体:0.0025mol·L-1 B. D气体:0.002mol·L-1
C. A气体:0.002mol·L-1 D. C气体:0.001mol·L-1
13. 常温下,盐酸与氨水混合,所得溶液pH=7,则此溶液中
A. [NH4+]<[Cl-] B. [NH4+]=[Cl-]
C. [NH4+]>[Cl-] D. 无法确定[NH4+]与[Cl-]的关系
14. 中小学生经常使用的涂改液中含有挥发性的有毒溶剂,应告诫学生尽量不要使用,以减少对身体的毒害及对环境的污染,该溶剂是
A. 乙醇 B. 乙酸 C. 甘油 D. 三氯乙烯
15. 向下列物质的溶液中通入足量的CO2,最终溶液中没有固体物质的是
A. 饱和碳酸钠溶液 B. 偏铝酸钠溶液
C. 硅酸钠溶液 D. 次氯酸钙溶液
16. 板蓝根速效感冒冲剂的主要成分之一为“对乙酰氨基酚”,其结构简式为:![]() ,有关它的性质描述不正确的是
,有关它的性质描述不正确的是
A. 它不能够发生消去反应
B. 在人体内能水解
C. 1mol对乙酰氨基酚与NaOH溶液反应时最多消耗NaOH 1mol
D. 与对硝基乙苯互为同分异构体
第Ⅱ卷(非选择题 共60分)
三、(本题包括2小题,共16分)
17. (4分)下列实验中,不能达到预期的目的的是 (填选项编号)
A. 用升华法分离碘和氯化铵的混合物
B. 用分液法分离水和硝基苯的混合物
C. 用蒸馏法分离乙醇(沸点78℃)和乙酸乙酯(沸点77.5℃)的混合物
D. 将甲烷与氯气混合光照制中二氯甲烷
E. 用电石和饱和食盐水制乙炔
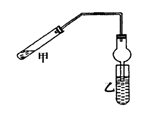 F.
用酒精和稀硫酸混合加热至170℃制乙烯
F.
用酒精和稀硫酸混合加热至170℃制乙烯
18. (12分)如图,在试管甲中先加入2mL95%的乙醇,并在摇
动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2g无水乙
酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中
加入5mL饱和碳酸钠溶液,按图连接装置,用酒精灯对试管甲加
热,当观察到试管乙中有明显现象时停止实验。试回答:
(1)试管甲中发生的主要反应的化学方程式 。
(2)试管乙中观察到的现象是 。
(3)加入浓硫酸的目的是 。
(4)该实验中使用球形管除起冷凝作用外,另一重要作用是 。
(5)试管乙中饱和碳酸钠溶液的作用是 。
(6)停止实验后,对试管乙中的混合物加以分离,其操作名称为 。
四、(本题包括2小题,共14分)
19. (6分)我们穿着的衣物有棉、麻、丝、毛等天然高分子材料。棉、麻的主要成份
是 ,它水解的最终产物是 ;丝、毛水解的最终产物是 。
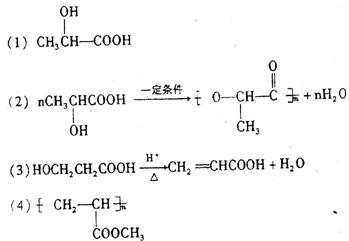
20. (8分)我国农科院开发出可自行降解的绿色包装材料,为解决使用一次性聚苯乙烯材料造成的“白色污染”,找到了新的替代品,该材料的主要成份是聚乳酸。
(1)1mol丙酮酸(CH3![]() CCOOH)在镍催化剂作用下加1mol氢气转变成乳酸,乳酸的结构简式是
。
CCOOH)在镍催化剂作用下加1mol氢气转变成乳酸,乳酸的结构简式是
。
(2)写出乳酸在一定条件下生成聚乳酸的化学反应方程式 。
(3)与乳酸具有相同官能轩的乳酸的同分异构体A在酸性条件下,加热失水生成B,由A生成B的化学反应方程式是 。
(4)B的甲酯可以聚合,聚合物的结构简式是 。
五、(本题包括1个小题,14分)
21. (14分)有机高分子聚合物F的合成路线可设计如下,其中A的氧化产物不发生银镜反应(已知![]() +2H2O,丙酮不能发生银镜反应)
+2H2O,丙酮不能发生银镜反应)
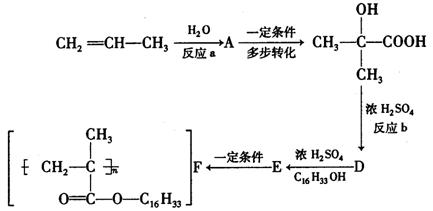
请写出
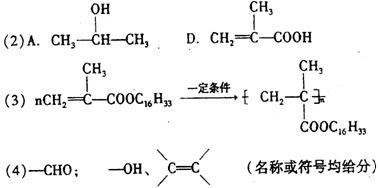
(1)反应类型:a ;b 。
(2)有机物A、D的结构简式:A ;D 。
(3)E→F的化学方程式 。
(4)有机物D的某种同分异构体,能与银氨溶液发生银镜反应,具催化加氢后得到
![]()
![]() CH2—CH2—CH2—CH2,则该同分异构体中一定含有的官能团是
,可能含
CH2—CH2—CH2—CH2,则该同分异构体中一定含有的官能团是
,可能含
OH OH
有的官能团有 。
六、(本题包括2个小题,共16分)
22. (8分)1体积某烃的蒸气完全燃烧生成的CO2比水蒸气少1体积(在相同状况下测定)。0.01mol该烃完全燃烧,其燃烧产物通入足量石灰水中生成6g白色沉淀。该烃的分子式为
。若它的一氯取代物有三种同分异构体,则该烃可能的结构简式及名称。
| 结构简式 | 名称 |
23. (8分)有一元羧酸和一元醇形成的酯A。燃烧7.4gA可生成5.4g水和标况下6.72LCO2。3.7gA与100mL0.8mol·L-1NaOH溶液共热,当完全水解后,为中和剩余的碱液,耗去0.5mol·L-1盐酸60mL。
(1)求A的分子式。
(2)写出A可能的结构简式。
下学期高二化学期末考试答案
第Ⅰ卷
1. C 2. B 3. D 4. C 5. D 6. B 7. D 8. C 9. D 10. B 11. A 12. D
13. B 14. D 15. D 16. C
第Ⅱ卷
17. (4分)ACDF(每对1个给1分,每错选一个倒扣1分)
18. (12分,每小题各2分)
(1)CH3COOH+CH3CH2OH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
(2)液体分层
(3)制乙酸,作催化剂和吸水剂
(4)防止倒吸
(5)除去酯中混有的杂质有利于分层
(6)分液
19. (6分,每空2分)纤维素 葡萄糖 氨基酸
20. (8分,每空2分)
21. (14分,每空2分)
(1)a.加成反应 b.消去反应
22. (8分)C6H14(2分)
| CH3CH2 CH2 CH2 CH2 CH3(2分) | 已烷(1分) |
|
CH3 | 2,2—二甲基丁烷 (1分) |
23. (8分)
(1)与A水解产生的羧酸中和时消耗NaOH的物质的量:
0.1L×0.8mol·L-1-0.06L×0.5mol·L-1=0.05mol(1分)
A的摩尔质量:![]() =74g·mol-1(1分)
=74g·mol-1(1分)
设A的分子式为CxHyOz:
CxHyOz+(x+![]() -
-![]() )O2→xCO2+
)O2→xCO2+![]() H2O
H2O
1mol 22.4xL 9yg
![]() mol
6.72L 5.4g
mol
6.72L 5.4g
![]() x=3
x=3
解得
y=6
z=![]() =2
=2
则A的分子式为C3H6O2(1分)
(2)可能的结构简式为CH3COOCH3 HCOOCH2CH3。(1分)
—