高二下学期化学期末考试
第I卷
一、选择题(本题包括8小题,每小题4分,共32分,每小题只有一个选项符合题意。)
1、规范市场,诚信交易对科学生产和消费都十分重要,下列使用化学物质处理食品的方法中,正确的是
A、用工业酒精兑白酒 B、用硫磺熏制出白净的粉丝
C、腌制食品中添加NaNO2应严格控制用量 D、用“福尔马林”溶液保鲜海参、鱿鱼
2、某学生课外化学小组,分别通过下列方法探究Fe(OH)3胶体的凝聚性
①加少量的去离水分 ②加AI(OH)3胶体 ③加硅酸胶体 ④加MgSO4溶液
⑤加硫化砷胶体,其中都能观察到Fe(OH)3凝聚的是
A、②③ B、①③⑤ C、③④ D、①④⑤
3、某条件下反应2CH4![]() C2H2+3H2可进行,在1L真空容器中充入1molCH4,达到平衡后测得CH4含量为m%,若相同条件下往此容器中充入2molCH4,平衡后CH4的含量
C2H2+3H2可进行,在1L真空容器中充入1molCH4,达到平衡后测得CH4含量为m%,若相同条件下往此容器中充入2molCH4,平衡后CH4的含量
A、大于m% B、等于m% C、小于m% D、无法判断
4、科学家致力二氧化碳的“组合转化”技术研究,把过多的二氧化碳转化为有益于人类的物质,如将CO2与H2混合,在一定条件下以1:3的比例发生反应,生成某种重要的化工原料和水,该化工原料可能是
A、烷烃 B、烯烃 C、快烃 D、方香烃
5、已知强酸与强碱在稀溶液里反应的中和热可表示为:
![]() △H=-57.3KJ/mol
△H=-57.3KJ/mol
![]() △H=-QKJ/mol
△H=-QKJ/mol
1/2H2SO4+NaOH(aq)=1/2Na2SO4(aq)+H2O(1) △H=-Q2KJ/mol
HNO3(aq)+NaOH(aq)=NaNO3(aq)+H2O(1) △H=-Q3KJ/mol
上述反应均系在溶液中进行反应,Q1、Q2、Q3的关系正确的是
A、Q1=Q2=Q3 B、Q2>Q1>Q3 C、Q2>Q3>Q1 D、Q2=Q3>Q1
6、设NA表示阿伏加德罗常数值,下列有关叙述不正确的是
A、常温常压下,1mol甲基(-CH3)所含的电子数为10NA
B、0.4mol以任意比例混合的乙炔和乙醛的混合物,在氧气中充分燃烧消耗氧气的分子数NA
C、常温常压下,NA个甲烷分子的体积大小22.4L
D、0.1molK2O2与水反应时,转移的电子数为0.1NA
7、在一定条件下,下列物质既能与HCI作用,又能与NaOH作用的是
①NaHCO3 ②NH4HS ③AI(OH)3 ④AgNO3 ⑤Fe(NO3)2
⑥H2NCH2COOH ⑦CH3CH=CHCOOH
A、全部 B、除④⑤⑦外 C、除⑤⑦外 D、其它组合
8、下列过程需要通电后才能进行的是
①电离 ②电解 ③电镀 ④电泳 ⑤电化腐蚀
A、①②③ B、②③④ C、②④⑤ D、全部
二、选择题(本题包括10小题,每小题4分,共40分,每小题有1—2个选项符合题意。)
9、将0.2mol·L-1HCN溶液和0.1mol·L-1NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是
A、c(HCN)< c(CN-) Bc(Na+)>c(CN-)
C、c(HCN)-c(CN-)=c(OH-) D、c(HCN)+c(CN-)=0.1mol·L-1
10、关于氢键,下列说法正确的是
A、每个水分子内含有两个氢键 B、分子间形成的氢键使物质的熔点和沸点升高
C、冰、水中都存在氢键 D、H2O是一种非常稳定的化合物,这是由于氢键所致
11、“白色污染”泛指塑料污染,常见的塑料有①聚乙烯 ②聚丙烯 ③聚氯乙烯
④聚苯乙烯等,下列关于它们的叙述正确的是
A、都是烯烃 B、分子内部都含有双键
C、它们的单体都能发生加聚反应 D、它们的分子结构都是空间网状结构
12、市场上有一种加酶洗衣粉,即在洗衣粉中加入少量的碱性蛋白酶,它的催化活性很强,衣物的汗渍,血迹及人体排放的蛋白质油渍遇到它,皆能水解而除去,下列衣料中不能用加酶洗衣粉洗涤的是
①棉织品 ②毛织品 ③腈纶织品 ④蚕丝织品 ⑤涤纶织品 ⑥锦纶织品
A、①②③ B、②④ C、③④⑤ D、③⑤⑥
13、下列实验方案合理的是
A、混有少量乙酸、乙醇杂质的乙酸乙酯可用饱和Na2CO3溶液除杂
B、用加入浓溴水的方法分离苯和酚混合物
C、用燃烧的方法除CO2中混有的少量CO
D、用热的氧化铜除去N2中混有的少量O2
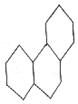 14、菲是一种稠环芳烃,其结构式中有三个环相并合(如图,其中双键未标出),每个碳原子上都有一个碳碳双键,下列说法正确的是
14、菲是一种稠环芳烃,其结构式中有三个环相并合(如图,其中双键未标出),每个碳原子上都有一个碳碳双键,下列说法正确的是
A、它的化学式是C14H24
B、菲易发生加成反应,不易发生取代反应
C、它的一氯化物有7种
D、1个菲分子中有7个双键
![]()
15、异丙基已烷 分子的一氯取代物的同分异构体的数目有
A、3种 B、4种 C、5种 D、6种
16、某有机物X能发生水解反应,水解产物为Y和Z,同温同压下,相同质量的Y和Z的蒸气所占体积相同,化合物X可能是
A、乙酸丙酯 B、甲酸乙酯 C、乙酸甲酯 D、乙酸乙酯
17、甲醛与某单烯烃的混合物含氧质量分数为x,则含碳、氢的质量分数为
A、![]() B、
B、![]() C、
C、![]() D、无法确定
D、无法确定
18、常温常压下,下列气态烃与O2的混合气体8L,充分反应后,将生成物通过浓H2SO4,恢复到原来状态,气体体积变为4L,则该烃可能是①CH4 ②C3H6 ③C3H8 ④C2H2
A、③⑤除外 B、⑤除外 C、仅①② D、①③④
第II卷
三、(共19分)
19、(7分)向淀粉溶液中加入少量稀硫酸,并加热使之发生水解,请你设计实验,测定水解的程度:
(1)所用试剂
(2)操作现象结论
。
20、(12分)某液态卤代烷RX的密度是ag·cm-3,该RX可以跟稀碱发生水解反应,生成ROH(能跟水互溶)和HX,为了测定RX的分子量,拟定的实验步骤如下:
①准确量取该卤代烷bmL,放入锥形瓶中;
②在锥形瓶中加入过量稀NaOH溶液,塞上带有长玻璃管的塞子,加热发生反应;
③反应完成后,冷却溶液,加稀HNO3酸化,滴加过量AgNO3溶液得到白色沉淀;
④过滤、洗涤、干燥后称重,得到固体cg
回答下面问题;
(1)装置中工玻璃管的作用是
(2)步骤④中洗涤的目的是为了除去沉淀上吸附的 离子;
(3)该卤代烷中所含卤素的名称是 ,判断的依据是 ;
(4)该卤代烷的相对分子质量是 (列出算式);
(5)如果在步骤③中,加HNO3的量不足,没有将溶液酸化,则步骤④中测得的C值(填下列选项代码) 。
A、偏大 B、偏小 C、不变 D、大小不定
四、(共16分)
21、(8分)从H+、Na+、Cu2+、CI-、![]() 五种离子中恰当地组成电解质,按下列要求进行电解:
五种离子中恰当地组成电解质,按下列要求进行电解:
(1)以碳棒为电极,使电解质质量减少,水量不变进行电解,则采用的电解质是
(2)以铂片为电极,使电解质质量不变,水量减少进行电解,则可采用的电解质是
。
(3)以碳棒为阳极,铁棒为阴极,使电解质和水量都减少,则可采用的电解质是
(4)以铜棒为阳极,铁棒为阴极,使电解质和水量都不变,则可采用的电解质是
22、(8分)1100℃时,在恒容闭容器中发生可逆反应:Na2SO4(s)+4H2(g)![]() Na2S(s)+4H2O(g)△H=QKJ/mol,并达到平衡,回答以下问题:
Na2S(s)+4H2O(g)△H=QKJ/mol,并达到平衡,回答以下问题:
(1)降低温度平衡 移动(“正向”“逆向”“不发生”)
(2)加入少量Na2SO4,则平衡 移动(“正向”“逆向”“不发生”)
(3)加入少量灼热的Fe3O4粉末,则平衡 移动(“正向”“逆向”“不发生”)
(4)若初始时加入的Na2SO4是2.84g是2.8g,Na2SO4的平衡转化率为45%,则达到平衡时该容器内固体的总质量为 。
五、(共24分)
23、(12分)按下列要求写出有机物的分子式或结构式:
(1)与CH4含碳质量分数相同的两种有机物的分子式 , 。
(2)某有机物的分子式为C2H5O2N,写出可能的结构式:
, , , 。
24、(12分)有A、B、C、D、E、F6种有机物,它们是烃或烃的衍生物,在一定条件下,有下图所示转化关系
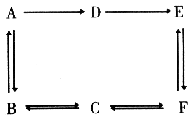
A可氧化成D,A的气体与相同条件下一氧化碳的密度相同,B与碱溶液共煮可得物质C和无机盐G,在反应后溶液中加入稀硝酸至酸性,再加硝酸银溶液得到淡黄色沉淀。
回答下列问题:
(1)B→A的反应属 反应,C和E→F的反应属 反应。
(2)按要求写出反应方程式(有机物用结构简式)
①B→A的反应方程式
②B→C的反应方程式
③D→E的离子方程式
④C和E→F的反应方程式
六、(共19分)
25、(8分)有机物A、B分子式不同,它们只可能含碳、氢、氧元素中的两种或三种。如果将A、B不论以何种比例混合,只要其物质的量之和不变,完全燃烧后生成的CO2和消耗的氧气的物质的量也不变。那么:
(1)A、B满足的条件是
(2)试写出符合上述条件且分子量最小的A和B的结构简式
(3)若A为C3H4,则B可能的分子式为
(4)若A为C4H8O,则B的分子式可能是
26、(11分)某1mol链烃A在一定条件下完全裂解成1mol烷烃B和1mol烯烃C,生成的混合气体对氢气的相对密度为14.5,通过计算回答下列问题:
(1)写出链烃A可能的结构简式和名称;
(2)烷烃B和烯烃C可能各是什么?
(3)如果要求1molB完全燃烧时面要氧气的物质的量是整数,那么C只能是什么烯烃?
下学期高二化学期末考试答案
一、选择题(每题4分,共32分)
1、C 2、C 3、A 4、B 5、D 6、A 7、A 8、B
二、选择题(每题4分,共40分)
9、BD 10、BC 11、C 12、B 13、A 14、D 15、D 16、AB
17、AC 18、D
三、(共19分)
19、(1)碘溶液 银氨溶液(或新制Cu(OH)2)碱溶液 (3分)
(2)中和后加入碘溶液显蓝色 加银氨溶液加热有镜则部分水解(2分)
加碘不显蓝色全部水解 加银氨溶液加热无银镜产生没有水解(2分)
20、(1)冷凝迥流,防挥发 (2)Ag+、 Na+ 、![]() (3)氯、白色沉淀
(3)氯、白色沉淀
(4)143.5ab/c (5)偏大A (每线2分)
四、(共16分)
21、(1)CuCI2 、HCI (2)Na2SO4、H2SO4 (3)NaCI、CuSO4 (4)CuCI2、CuSO4
22、(1)逆向 (2)不发生 (3)逆向 (4)2.264 (每线2分)
五、(共24分)
23、(1)C8H16O C9H20O或C10H8O2
|
|
|
(2)CH3CH2NO2 CH2—C—OH H—C—O—CH2—NH2
|
HO—CH2—C—NH2
24、(1)硝去反应 酯化反应
|
(2)①CH3CH2Br+NaOH—→CH2=CH2+NaBr+H2O
|
②CH3CH2Br+H2O—→CH3CH2OH+HBr
|
③CH3CHO+2Ag(NH3)2++2OH-—→CH3COO-+![]() +2Ag++3NH3+H2O
+2Ag++3NH3+H2O
|
④CH3CH2OH+CH3COOH—→CH3COOC2H5+H2O (每线2分)
六(共19分)
25、(1)A、B分子中含C质子数相等,分子中相差几个氧元子必定相差2n个H元子
(2)CH三CH CH3CHO (3)C3H6O C3H8O2 (4)C4H6 C4H10O2
|
26、(1)CH3CH2CH2CH3 正丁烷 CH3—CH—CH3 异丁烷 (4分)
(2)甲烷、丙烯 或 乙烷、乙烯 (4分)
(3)丙烯CH3CH=CH2 (3分)