高二化学综合测试题
一、选择题
1.把下列4种X的溶液:①10mL2mol/L;②20mL2mol/L;③10mL4mol/L;④20mL3mol/L,分别加进4个盛有10mL2mol/L的盐酸的烧杯中,并均加水稀释至50mL,此时X和盐酸和缓地进行反应,则各烧杯中反应速率大小关系正确的是( )
A.①<②<③<④ B.①<②=③<④
C.①=②<④<③ D.①=③<②=④
2.反应速率v和反应物浓度的关系是用实验方法测定的.化学反应H2+Cl2![]() 2HCl的反应速率v可表示v=K〔c(H2)〕m·〔c(Cl2)〕n,式中K为常数,m,n值可用下表中数据确定.由此可推得,m,n值正确的是( )
2HCl的反应速率v可表示v=K〔c(H2)〕m·〔c(Cl2)〕n,式中K为常数,m,n值可用下表中数据确定.由此可推得,m,n值正确的是( )
| c(H2)(mol/L) | c(Cl2)(mol/L) | v〔mol/(L·s)〕 |
| 1.0 | 1.0 | 1.0K |
| 2.0 | 1.0 | 2.0K |
| 2.0 | 4.0 | 4.0K |
A.m=1,n=1 B.m=![]() ,n=
,n=![]() C.m=
C.m=![]() ,n=1 D.m=1,n=
,n=1 D.m=1,n=![]()
3.能除去NO中的NO2的试剂与装置是( )

4.下列说法中,可以说明反应N2+3H2![]() 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
A.1个N≡N键断裂的同时,有3个H—H键形成
B.1个N≡N键断裂的同时,有3个H—H键断裂
C.1个N≡N键断裂的同时,有6个N—H键断裂
D.1个N≡N键断裂的同时,有6个N—H键形成
5.在一个固定体积的密闭容器中,温度一定,发生反应:
H2(g)+Br2(g) ![]() 2HBr(g)
2HBr(g)
已知加入1molH2和2molBr2时,达到平衡后,生成amolHBr,在相同条件下,起始时加入H2、Br2、HBr的物质的量分别为x、y、z(均不为零),如果仍保持平衡时,各组分的组成不变,以下推断不正确的是( )
A.x、y应满足的关系是 y=2x
B.x、y、z应满足的关系是 4x+z=2y
C.达平衡时HBr的物质的量为 (x+y+z)·![]() mol
mol
D.达平衡时HBr的物质的量一定仍为 amol
6.在密封容器中通入A、B两种气体,在一定条件下反应:2A(气)+B(气) ![]() 2c(气)+Q(Q>O)达到平衡后,改变一个条件(x),下列量(y)一定符合下图中曲线的是( )
2c(气)+Q(Q>O)达到平衡后,改变一个条件(x),下列量(y)一定符合下图中曲线的是( )
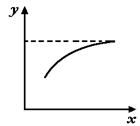
| x | y | |
| A | 再加入A | B的转化率 |
| B | 再加入C | A的体积分数 |
| C | 压强 | A的转化率 |
| D | 温度 | 混合气体的平均摩尔质量 |
7.(2002年湖北八市联考)在密闭容器中一定量混合气体发生反应:2A(g)+B(g)![]() xc(g),达到平衡时测得A的浓度为0.5mol/L,在温度不变的条件下,将容器中的容积扩大2倍,再达平衡时,测得A的浓度为0.3mol/L,下列有关判断正确的是( )
xc(g),达到平衡时测得A的浓度为0.5mol/L,在温度不变的条件下,将容器中的容积扩大2倍,再达平衡时,测得A的浓度为0.3mol/L,下列有关判断正确的是( )
A.x=3 B.平衡向正反应方向移动
C.B的转化率降低 D.C的体积分数增大
8.稀H2SO4中插入一块铜片,加入下列物质后,可使Cu片迅速发生腐蚀的是( )
A.稀盐酸 B.FeCl3晶体 C.Na2SO4晶体 D.KNO3晶体
9.下列各组物质的稳定性比较时,前者强于后者的是( )
A.KMnO4与K2MnO4 B.KNO3与KNO2 C.HNO3与HNO2 D.Na2CO3与Li2CO3
10.下列化肥:①KNO3 ②KH2PO4 ③过磷酸钙 ④尿素 ⑤(NH4)2HPO4 ⑥重钙,属于复合肥料的是( )
A.①②③④⑤ B.①②⑤ C.②③⑥ D.②⑤⑥
11.一包氯化铵中混入了下列氮肥的一种,经测定,这包氯化铵中含N为23.7%.混入的氮肥是( )
A.尿素 B.硝酸铵 C.碳酸铵 D.硫酸铵
12.以下气体因与人体血液中血红蛋白作用引起中毒的是( )
A.NO B.CO C.NO2 D.NH3
13.将20mL二氧化氮和氨气的混合气体,在一定条件下充分反应,化学方程式是6NO2+8NH3![]() 7N2+12H2O,已知参加反应的二氧化氮比氨气少2mL(气体体积均在相同状况下测定),则原混合气体中二氧化氮和氨气的物质的量之比是( )
7N2+12H2O,已知参加反应的二氧化氮比氨气少2mL(气体体积均在相同状况下测定),则原混合气体中二氧化氮和氨气的物质的量之比是( )
A.3∶2 B.2∶3 C.3∶7 D.3∶4 E.92∶61
14.在一固定体积的密闭容器中,加入2molA和1molB,发生反应如下;2A(气)+B(气) ![]() 3C(气)+D(气)当反应达到平衡时,C的浓度为Wmol/L.若维持容器体积和温度不变,按下列四种配比作为起始物质,达平衡后,C的浓度仍为Wmol/L是( )
3C(气)+D(气)当反应达到平衡时,C的浓度为Wmol/L.若维持容器体积和温度不变,按下列四种配比作为起始物质,达平衡后,C的浓度仍为Wmol/L是( )
A.4molA+2molB B.2molA+1molB+3molC+1molD
C.3mol+1molB+1molB D.3molC+1molD
15.金属钾与金属钠的金属相相近,且钾比钠略强.当利用金属钾与钠盐共熔制金属钠时,发现钾与钠的共熔体难以分离.如调整温度到一定温度,则可用金属钠与氯化钾反应,制出金属钾.下面是四种物质的熔沸点:
K Na KCl NaCl
熔点(℃) 63.65 97.8 770 801
沸点(℃) 774 882.9 1500(升华) 1413
根据平衡移动原理,可推知,用钠与氯化钾反应制金属钾的适宜温度是( )
A.97.8℃~770℃ B.770℃~774℃
C.850℃左右 D.1413℃~1500℃
16.在一定温度下,可逆反应A(气)+3B(气) ![]() 2C(气),达到平衡的标志是( )
2C(气),达到平衡的标志是( )
A.C生成的速率与C分解的速度相等
B.单位时间生成nmolA,同时生成3nmolB
C.A、B、C的浓度不再变化
D.A、B、C的分子数比为1∶3∶2
17.在一定条件下,合成氨反应达到平衡后,混合气体中NH3的体积占25%.若反应前后条件保持不变,则反应缩小的气体体积与原反应物体积的比值是( )
A.1/5 B.1/4 C.1/3 D.1/2
二、填空题
1.可逆反应2SO2(g)+O2(g) ![]() 2SO3(g)在密闭容器中达到平衡后,再通入少量含18O的氧气,结果发现SO2中出现了这种原子,能否推测体系再次达到平衡?
.
2SO3(g)在密闭容器中达到平衡后,再通入少量含18O的氧气,结果发现SO2中出现了这种原子,能否推测体系再次达到平衡?
.
2.在四个密闭容器中,分别充入表中四种配比气体,发生下列反应:2A(g)+B(g) ![]() 3c(g)+D(g),在一定条件下达到平衡后,回答下列问题:
3c(g)+D(g),在一定条件下达到平衡后,回答下列问题:
|
容器 | A/mol | B/mol | C/mol | D/mol |
| 1 | 2 | 1 | 0 | 0 |
| 2 | 4 | 2 | 0 | 0 |
| 3 | 1 | 0.5 | 1.5 | 0.5 |
| 4 | 0 | 0 | 9 | 3 |
(1)若四容器体积相同且不变,在恒温条件下达到平衡:
①平衡状态完全相同的容器是 ;
②与A的物质的量相同的容器是 ;
③与A的物质的量浓度相同的容器是 。
(2)若同温同压,四容器的体积可变,回答(1)中对应的问题:① ;② ;③ .
3.根据反应2H2S(g)+SO2(g)![]() 2H2O+3S↓,进行以下实验操作:用A、B两支100mL注射器,先同时分别吸入60mLH2S气体,然后同时吸入30mLSO2气体,并分别迅速密封针头的注射小孔,立即将A注射器的活塞推压到体积约为40mL.A、B两注射器内发生不同的现象,主要是 ,原因是 。
2H2O+3S↓,进行以下实验操作:用A、B两支100mL注射器,先同时分别吸入60mLH2S气体,然后同时吸入30mLSO2气体,并分别迅速密封针头的注射小孔,立即将A注射器的活塞推压到体积约为40mL.A、B两注射器内发生不同的现象,主要是 ,原因是 。
4.在一定温度下将3体积A气体和1.5体积B气体充入一个装有活塞的容器中发生如下反应:
| A:3体积 B:1.5体积 | 大气 |
2A(g)+B(g)![]() 2c(g)+Q
2c(g)+Q
当反应达到平衡后,测得混合气体为4体积.据此回答:
(1)保持温度不变,设a、b、c分别代表起始加入的A、B、C气体的体积.若反应达到平衡后,混合气体各种气体的百分含量仍与上述平衡时完全相同,那么:
①若a=2.5,c=0.5,则b= ,在此情况下,起始时反应将向 方向进行(填“正反应”或“逆反应”);
②若规定起始时反应向逆反应方向进行,则c的取值范围是 .
(2)在上述装置中,若需控制平衡后混合气体为3.5体积,则采取的措施是 ,理由是 .
5.A、B、C是中学化学中常见的三种化合物,它们各由两种元素组成,甲、乙是两种单质.这些化合物和单质之间存在如下关系:
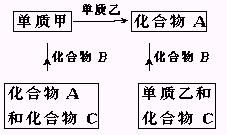
据此判断:
(1)在A、B、C这三种化合物中,必定含有乙元素的是 (用A、B、C字母填写).
(2)单质乙必定是 (填金属或非金属)其理由是 .
(3)单质乙的分子式可能是 .则化合物B的分子式是 .
6.工业上将磷酸钙、石英砂和炭粉混合,在电弧炉中焙烧来制取白磷:
Ca3(PO4)3+ SiO2+ C→ CaSiO3+ P↑+ CO↑
(1)上述方程式配平后各物质的系数依次为: .
(2)反应中得到的气体密度折合成标准状况下为1.64g/L.据此计算反应制得的白磷的分子量(要求计算过程).
(3)根据以上计算推断白磷的分子组成为 ,其空间结构为 .
7.高炉炼铁的基本反应之一如下:
FeO(s)+CO(g) ![]() Fe(s)+CO2(g)+Q
Fe(s)+CO2(g)+Q
该反应达到平衡时,![]() 是一个常数(用K表示),已知1100℃时,K=0.263.
是一个常数(用K表示),已知1100℃时,K=0.263.
(1)温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比值 ,K值 (填“增大”“减小”或“不变”).
(2)1100℃时测得高炉中c(CO2)=0.025mol·L-1,c(CO)=0.1mol·L-1,此时该反应是否处于化学平衡状态 ,此时化学反应速率是v正 v逆,其原因是 .
8.可逆反应A(气)+3B(气) ![]() 2C(气),在反应过程中C的百分含量(C%)与温度关系如图所示,请回答:
2C(气),在反应过程中C的百分含量(C%)与温度关系如图所示,请回答:
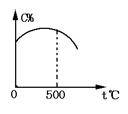
(1)正反应是 反应(吸热、放热)
(2)t<500℃时,C%逐渐增大,是因为 .
(3)t>500℃时,C%逐渐减小,是因为 .
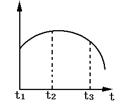
9.把除去氧化膜的镁条投入到盛有稀盐酸的试管中,发现氢气发生的速度变化情况如图所示.其中t1~t2速度变化的主要原因是 ,t2~t3速度变化的重要原因是 .
10.有两支密闭容器A和B,A容器有一个移动的活塞能使容器内保持恒压,B容器能保持恒容.起始时向这两只容器中分别充入等量的体积比为2∶1的SO2与O2的混合气体,并使A和B容积相等,如下图.在保持400℃的条件下使之发生如下的反应:
2SO2+O2![]() 2SO3,填写下列空格:
2SO3,填写下列空格:
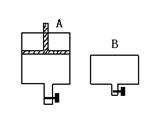
(1)达到平衡时所需的时间A容器比B容器 ,A容器中SO2的转化率比B容器 .
(2)达到(1)所述平衡后,若向两容器中通入数量不多的等量氩气,A容器化学平衡 移动,B容器化学平衡 .
(3)达到(1)所述平衡后,若向两容器中通入等量的原反应气体,达到平衡时,A容器中SO3的百分含量 (增大、减小、不变);B容器中SO3的百分含量 (增大、减小、不变).
三、计算题
1.将一定质量的Cu放入盛有100mL稀硝酸(ρ=1.12lg/cm3)的烧杯中,当反应停止后还有Cu剩余,除去残渣后溶液的质量为118.2655g,求:
①参加反应的Cu的质量;
②反应前HNO3的百分比浓度;
③反应后Cu(NO3)2溶液的百分比浓度.
2.在密闭容器中放入(NH4)2CO3和NaOH两种固体共ag,将容器加热到200℃,经充分反应后,排除其中的气体,冷却后称得剩余的固体质量为bg.问在原容器中(NH4)2CO3和NaOH各多少克?
3.在273K时把11.5gN2O4气体通入体积为500mL的真空密闭容器中,立即出现了红综色.反应进行到2秒时,NO2含量为0.01mol,进行到60秒时达到平衡,此时容器内混合气的密度是氢气密度的28.75倍,则:
(1)开始2秒内有N2O4表示的反应速度为多少?
(2)达平衡时,体系的压强是开始时的多少倍?
(3)平衡时N2O4的物质的量?
(4)平衡后,若压缩容器体积,则再达平衡后,NO2浓度将如何变化?
参考答案:
一、1.B 2.D 3.BD 4.AC 5.AD 6.AD 7.B 8.D 9.BC 10.B 11.D 12.A、B 13.A、C 14.D 15.C 16.A、C 17.A
二、1.不能 2.略 3.A 注射器壁上立即出现淡黄色固体;增大压强,反应速率加快. 4.(1)①1.25;正反应 ②1<C≤3 (2)降温;因为3.5<4,上述平衡向气体体积缩小的方向移动,即向放热反应的方向移动,故应降温. 5.(1)AB. (2)非金属.;因为A+B乙+C,且乙为单质,则可知乙元素在A、B中分别呈正、负价,所以乙是非金属. (3)S、H2S(或N2、NH3) 6.(1)1,3,5,3,2,5 (2)124.32 (3)P4,正四面体
7.(1)增大;增大 (2)否;大于;因为此时![]() <0.263,而T不变,K不变,如增大
<0.263,而T不变,K不变,如增大![]() ,需v正>v逆
,需v正>v逆
8.(1)从图中分析看,该反应在500℃时达到平衡,平衡后温度继续升高时,C%降低,说明平衡向逆反应方向移动,则正反应是放热反应;(2)当t<500℃时,反应未达到平衡,温度升高,反应速度增加快,且V正>V逆,所以C%随温度升高而增大;(3)当t>500℃时,温度升高,反应速度加快,但V正<V逆,平衡向逆反应方向移动,所以C%随温度升高而减小. 9.镁条与盐酸反应放热,温度升高使反应速度加快;盐酸浓度减小,反应速度减慢.
随着反应的进行,盐酸的浓度减小,速度理应减慢,但从图像知t1~t2时间内速度加快,其原因只能是反应的热效应引起的.
10.(1)短,大; (2)逆,不; (3)不,增
三、1.(1)x=8.968(g) (2)22.27% (3)3.74(mol/L) 2.(NH4)2CO3的含量=![]() g或
g或![]() g;NaOH含量为
g;NaOH含量为![]() g或
g或![]() g. 3.(1)反应速度为0.005mol/L·s
g. 3.(1)反应速度为0.005mol/L·s
(2)在T、V不变时:![]() =
=![]() =
=![]() =1.04倍
=1.04倍
(3)平衡N2O4的物质的量:0.12mol.
(4)压缩容积,各物质浓度却增大,∴NO2的浓度亦增大.