![]()
|
|
学科:化学 |
| 教学内容:高二化学综合检测题 |
可能用到的相对原子质量
H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 S 32 Ca 40 Fe 56
【同步达纲练习】
一. 选择题(本题包括10个小题,每题2分,共20分,每小题只有一个选项符合题意)
1. 下列物质属于有机物的是( )
A. CO B. ![]()
C. ![]() D. SiC
D. SiC
2. 下列说法错误的是( )
A. 研究有机物的化学叫有机化学
B. 有机物必须是从有机生命体中取得的化合物
C. 有机物是指含碳元素的化合物
D. 组成有机物的元素除碳之外,通常还有H、O、N、S、P、卤素等.
3. 下列物质中沸点最低的是( )
A.纯碱 B.烧碱
C. 水 D.乙醇
4. 下列有机物命名正确的是( )
A. 1一甲基戊烷
B. 3,3一二甲戊烷
C. 2一乙基丁烷
D. 3,3一二甲基丁烷
5. ![]() 的名称是( )
的名称是( )
A. 三甲基,二乙基丙烷
B. 2--二甲基-3-二乙基戊烷
C. 2,2--二甲基—3,4--二乙基戊烷
D. 2,2--二甲基—3,4--二乙基己烷
6. 在①新戊烷 ②己烷 ③2,2一二甲基戊烷 ④2一甲基一1,3一丁二烯
⑤甲苯中属于同系物的是( )
A. ①②⑤ B. ③④⑤
C. ②③⑤ D. ①②③
7 验证某有机物属于烃,应完成的实验内容是( )
A.只测定它的C,H两种元素质量之比
B. 只要证明它完全燃烧后产物只有![]() 和
和![]()
C.只测定其燃烧产物![]() 和
和![]() 的物质的量的比值
的物质的量的比值
D.测定该试样的质量及试样燃烧后生成![]() 和
和![]() 的质量
的质量
8. 下列离子方程式书写不正确的是( )
A.向氢氧化铝中滴加少量盐酸
![]()
B.把少量![]() 溶液加入到NaOH溶液中
溶液加入到NaOH溶液中
![]()
C.向![]() 溶液中加入氨水
溶液中加入氨水
![]()
D.把石英浸泡在氢氧化钠溶液中
![]()
9. 下列关于同系物的叙述不正确的是( )
A.组成可用通式![]() 表示的烃不一定互为同系物
表示的烃不一定互为同系物
B.物质分子量相差14或者14整数倍的有机物一定互为同系物
C.组成通式符合![]() 的烃不一定互为同系物
的烃不一定互为同系物
D.同系物具有相似的化学性质
10. ![]() 和CO的混合气体完全燃烧,在相同条件下消耗等体积的
和CO的混合气体完全燃烧,在相同条件下消耗等体积的![]() ,则
,则![]() 与CO的体积比为( )
与CO的体积比为( )
A. 1:1 B. 1:2
C. 2:1 D. 1:3
二. 选择题(本题包括8个小题,每题3分,共24分,每小题有1~2个选项符合题意)
11. 在光照的条件下,将等体积的![]() 和
和![]() (常温常压)混合,得到物质的量最多的物质是( )
(常温常压)混合,得到物质的量最多的物质是( )
A. ![]() B.
B.![]()
C. ![]() D. HCl
D. HCl
12有一个含叁键的烃A,与氢气完全加成后产物的结构简式为
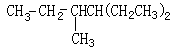 该烃A可能有的结构简式有( )
该烃A可能有的结构简式有( )
A. 1种 B. 2种 C. 3种 D. 4种
13. 在常温常压下,将2L乙烷和1L丙烷与100L空气混合,若使其完全燃烧后,将反应混合物经浓![]() 干燥后恢复至起始状态,其体积是( )
干燥后恢复至起始状态,其体积是( )
A. 103L B. 97L
C. 95L D. 88L
14. 在标准状况下,将两种气态烃组成的混合气体4.48L(标准状况)完全燃烧后的产物全部依次通入浓硫酸和氧化钠固体(皆过量)中,浓硫酸的质量加7.2g,过氧化钠质量增加6.72g,下列说法正确的是( )
A.一定没有丙炔
B.一定有乙烯
C. 一定有甲烷
D.一定是甲烷和乙烯的混合气
15. 两种气态烃以任意比例混合,在105℃时,1L该混合烃与![]() 混合,充分燃烧后恢复到原状态,所得气体体积极是10L,下列各组混合烃不符合此条件的是( )
混合,充分燃烧后恢复到原状态,所得气体体积极是10L,下列各组混合烃不符合此条件的是( )
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
16. 欲使![]() 的硫酸铝溶液中的铝元素一半在溶液中,一半在沉淀中,需加入
的硫酸铝溶液中的铝元素一半在溶液中,一半在沉淀中,需加入![]() 的氢氧化钠溶液的体积为( )
的氢氧化钠溶液的体积为( )
A. 15mL B. 30mL
C. 35ml D. 45mL
17. 用热的稀![]() 与足量铁粉反应,生成
与足量铁粉反应,生成![]() 和
和![]() ,如果收集到4.48L气体(标准状况)则被氧化的铁的质量为
,如果收集到4.48L气体(标准状况)则被氧化的铁的质量为
A. 5.6g B. 11.2g
C. 44.8g D. 22.4g
18 为提纯下列物质(括号内为杂质)所选用的除杂试剂和分离方法都不正确的是( )
选项 不纯物质 除杂试剂 分离方法
A. 己烷(己烯) 溴水 分液
B. 溴乙烷(乙醇) 水 分液
C. ![]() Cu粉 过滤 结晶
Cu粉 过滤 结晶
D. ![]() 饱和
饱和![]() 过滤
过滤
三.填空题
19. (1)大多数有机物都具有的性质是___________________(填序号)
A.离子晶体 B.原子晶体 C.分子晶体
D.易溶于水 E.溶沸点较低 F. 非电解质 G.可以燃烧
(2)工业上炼铁的主要原料是____________________________________
(3)工业上炼钢的实质是______________________碳的含量,除大部分____,把___含量调整到规定范围内.
(4)在元素周期表中过渡元素包括从ⅢB族到____族______个纵行,它们都是______元素(填金属或非金属),这些元素常常有可变的化合价,比如_____元素,我们常见的化合价有四种,分别是______________.
(5)磺化煤在长时间使用后将失去软化水的功能,使其再生的方法是将其浸泡在_____
(A饱和食盐水中 B 8%~10%的食盐水中)反应方程式是______
(6)若某硬水中![]() 的物质的量浓度为
的物质的量浓度为![]() ,
,![]() 的物质的量浓度为
的物质的量浓度为![]() ,
,![]() 的物质的量浓度为
的物质的量浓度为![]() ,
,![]() 离子的物质的量浓度为
离子的物质的量浓度为![]() 以及一定量的
以及一定量的![]() ,软化1000L这样的硬水的最佳方案是:需要石灰___g,纯碱____g.
,软化1000L这样的硬水的最佳方案是:需要石灰___g,纯碱____g.
四. 实验
20. (1)下列关于制取甲烷气体实验叙述中有无错误,若有请予改正
①把醋酸钠有结晶水的晶体与碱石灰混合均匀,用纸槽送入试管底部,旋紧单孔塞,
②试管口微微上斜,给试管均匀加热,然后固定加热,
③将生成的气体通入盛有溴水的锥形瓶中
④过一段时间后,溴水褪色,锥形瓶底部有无色油状的液体生成
改正:
①_____________
②_____________
③_____________
④_____________
(2)实验室制取乙烯时,浓硫酸的作用是_____________,化学反应方程式为_____________,发生的副反应有_____________(用化学方程式表示),为了证明确有![]() 和乙烯气体生成,请在下列方框内填入适当试剂名称并指明其作用,能写出化学方程式的请写出化学方程式
和乙烯气体生成,请在下列方框内填入适当试剂名称并指明其作用,能写出化学方程式的请写出化学方程式
![]()
五. 推断
21. 在标准状况下把2.24L某气态烃通入过量的溴水中,充分反应后溴水的质量增加了5.6g,该烃可能具有的结构简式和名称分别为__________________
22. 把某无水盐制成溶液,其焰色反应呈浅紫色(透过蓝色钴玻璃观察),向此溶液中滴入少量NaOH溶液,产生白色沉淀,继续加入过量NaOH溶液时沉淀溶解,再加入少量盐酸又产生白色沉淀,盐酸过量时沉淀又溶解;若继续加入硝酸钡溶液又生成白色沉淀,加入硝酸沉淀不溶解;由此可知,该盐的化学式为__________________,有关反应的离子方程式____________,_____________,____________.
23. 某灰黑色固体粉末A在空气中加热可以燃烧,放出大量热,生成化合物B;B可以与氢氧化钠溶液反应生成含A的化合物C,C的溶液在空气中长期放置有化合物D生成,将D加热又可以生成B.请依据上述变化过程
(1)推断各物质的名称A__________________D__________________
(2)写出C→D变化的化学方程式__________________
(3)固体A的最重要的用途有__________________(写出两种用途)
六. 计算题
24.5.8g丁烷完全燃烧后的产物全部通入![]() 的氢氧化钠溶液中(设产物完全被吸收),试确定溶液中各溶质的物质的量浓度(设反应前后溶液体积不变)
的氢氧化钠溶液中(设产物完全被吸收),试确定溶液中各溶质的物质的量浓度(设反应前后溶液体积不变)
25.由![]() 、
、![]() 、
、![]() 组成的混合粉末,其质量为44.2g,将其均匀地分为两份.若向其中的一份粉末中加入过量的盐酸,充分反应后,最多可收集到1.12L标准状况下的气体;若向另一份粉末中加入
组成的混合粉末,其质量为44.2g,将其均匀地分为两份.若向其中的一份粉末中加入过量的盐酸,充分反应后,最多可收集到1.12L标准状况下的气体;若向另一份粉末中加入![]() 的氢氧化钠溶液100mL后,充分搅拌,有沉淀生成,若向此浊液中滴加
的氢氧化钠溶液100mL后,充分搅拌,有沉淀生成,若向此浊液中滴加![]() 盐酸20mL沉淀没有减少,继续滴加盐酸则沉淀逐渐增加,当共加入
盐酸20mL沉淀没有减少,继续滴加盐酸则沉淀逐渐增加,当共加入![]() 的盐酸时沉淀量达到最大值,请计算三种物质各自的质量分数.[已知碳酸的酸性强于
的盐酸时沉淀量达到最大值,请计算三种物质各自的质量分数.[已知碳酸的酸性强于![]() ]
]

参考答案
【同步达纲练习】
一.1.B 2.B 3.D 4.B 5.D 6.D 7.D 8.B 9.B 10.B
二.11.D 12.B 13.C 14.C 15.B D 16.A C 17.C 18.D
三.19.(1)C E、F、G
(2)铁矿石,石灰石,焦炭,空气
(3)适当降低生铁中碳的含量 除去部分硫磷
把合金元素调整到规定范围内.
(4)ⅡB 10 金属 Mn ![]()
![]()
![]()
![]()
(5)B.
![]()
(6)![]()
1 2
0.15 0.3
![]()
1 1
0.05 0.05 0.05
需 CaO 0.35mol 19.6g
![]() 0.15mol 15.9g
0.15mol 15.9g
四.
20.(1)①用无水![]() (2)微微向下倾斜
(2)微微向下倾斜
④不褪色,无油状液体生成
(2)催化剂,脱水剂 ![]()
![]()
![]()
![]() (其二即可)
(其二即可)
→品红溶液(除去![]() )→品红溶液(证明
)→品红溶液(证明![]() 除净)→澄清石灰水
证明有
除净)→澄清石灰水
证明有![]() 存在
存在
![]()
→![]() 水褪色
证明有乙烯存在.
水褪色
证明有乙烯存在.
![]()
五.
21. ![]() 1—丁烯
1—丁烯
![]() 2—丁烯
2—丁烯
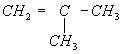 2—甲基—1—丁烯
2—甲基—1—丁烯
22.![]()
![]()
![]()
![]()
![]()
![]()
23.(1)A 硅 D 原硅酸
(2)![]()
(2)半导体材料,整流器,耐酸设备,炼钢的脱氧剂,变压器铁芯 制合金
六.
24. ![]() 0.1mol
0.1mol ![]() 0.4mol
0.4mol
NaOH 0.5mol ![]() 0.3mol
0.3mol
![]() 0.1mol
0.1mol
∴![]()
![]()
25. ![]() 0.05mol×2=0.1mol
0.05mol×2=0.1mol ![]() 10g
10g
![]() 0.02-0.01=0.01mol
0.02-0.01=0.01mol ![]() 0.1mol 10.2g
0.1mol 10.2g
![]() 24g
24g
![]() 22.62%
22.62%
![]() 23.08%
23.08%
![]() 54.30%
54.30%
